
- DAZ.online
- News
- Pharmazie
- Erstes vollständiges, ...
Zulassung in Kanada
Erstes vollständiges, langwirksames Regime zur Behandlung von HIV
Remagen - 09.04.2020, 11:30 Uhr

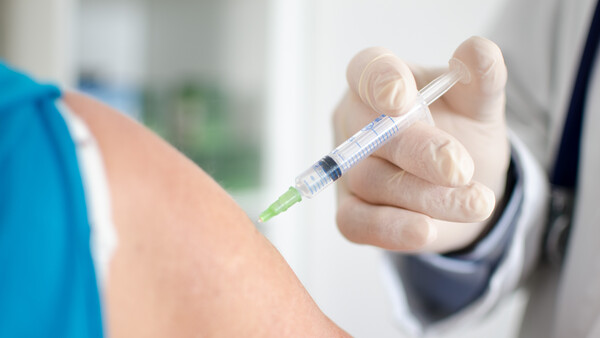
Nur noch einmal im Monat, statt täglich: Cabenuva reduziert die Dosierungstage der HIV-Behandlung von 365 auf zwölf pro Jahr. (m / Foto: Piman Khrutmuang /stock.adobe.com)
Zwei Schlüsselstudien: ATLAS und FLAIR
Die Zulassung von Cabenuva basiert nach Angaben von ViiV Healthcare auf den pivotalen Phase-III-Studien ATLAS (Antiretroviral Therapy as Long-Acting Suppression) und FLAIR (First Long-Acting Injectable Regimen) die kürzlich im New England Journal of Medicine veröffentlicht wurden. An beiden Studien hatten mehr als 1100 Personen aus 16 Ländern teilgenommen. In den Studien wurden Cabotegravir und Rilpivirin vor der Behandlung mit Cabenuva zunächst etwa einen Monat lang oral verabreicht, um die Verträglichkeit der beiden Wirkstoffe zu beurteilen. Über den 48-wöchigen Studienzeitraum zeigte sich, dass die Suspensionen der beiden Wirkstoffe bei intramuskulärer Injektion in das Gesäß einmal im Monat bezüglich der Aufrechterhaltung der Virussuppression genauso wirksam war wie die Fortsetzung der täglichen oralen antiretroviralen Therapie.
Etwa neun von zehn Patienten, die in den Studien ATLAS- und FLAIR auf Cabotegravir und Rilpivirin mit Langzeitwirkung umstellten, bevorzugten dieses Regime gegenüber der oralen Therapie.
Häufigste Nebenwirkungen
Die häufigsten Nebenwirkungen, die in beiden Studien bei ≥ 2 Prozent der Teilnehmer unter Cabenuva auftraten, waren Reaktionen an der Injektionsstelle, Fieber, Müdigkeit, Kopfschmerzen, Schmerzen des Bewegungsapparates, Übelkeit, Schlafstörungen, Schwindel, Hautausschlag und Durchfall. Während des 48-wöchigen Studienzeitraums brachen insgesamt 4 Prozent der Teilnehmer die Behandlung wegen unerwünschter Ereignisse ab.
Für über 65-jährige Patienten und für Personen unter 18 Jahren kommt die Kombination der beiden Suspensionen nicht in Frage, da sie hierfür nicht ausreichend untersucht ist. Eine weitere Gegenanzeige ist eine bekannte oder vermutete Resistenz gegen Cabotegravir oder Rilpivirin. Weitere wichtige Informationen zu Nebenwirkungen, Arzneimittelwechselwirkungen, Vorsichts-und Warnhinweisen, etc. finden Sie hier
Antrag bei der EMA schon gestellt
Das vollständige Langzeit-Regime mit Cabotegravir und Rilpivirin zur Behandlung von HIV-1-Infektionen wird derzeit auch von der Europäischen Arzneimittel-Agentur (EMA) und den Aufsichtsbehörden in der Schweiz und in Australien geprüft. Weitere Einreichungen bei Regulierungsbehörden sind laut ViiV Healthcare in den kommenden Monaten geplant.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.