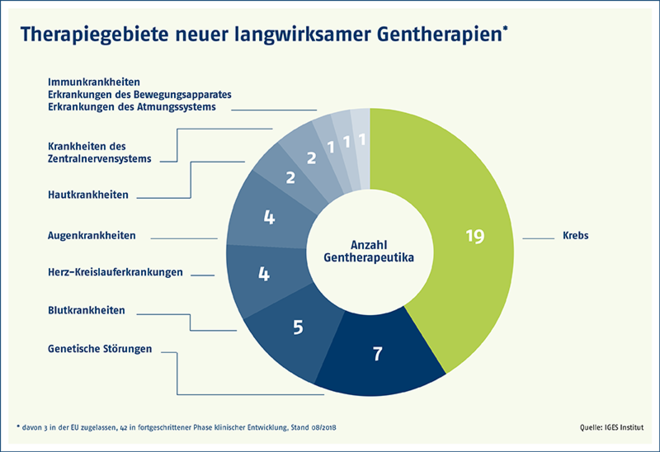
Zugelassene Gentherapeutika (GTMP) mit Indikationsgebiet und Zulassungsdatum
- Glybera® (Alipogen tiparvovec): Lipoproteinlipasedefizienz (LPLD) (10/2012 bis 10/2017)
- Imlygic® (Talimogen laherparepvec): Melanom (inoperabel, metastasiert) (12/2015)
- Strimvelis®: schwerer Immundefekt infolge eines Adenosin-Desaminase-Mangels (ADA-SCID) (05/2016)
- Kymriah® (Tisagenlecleucel): B-Zell akute lymphatische Leukämie (ALL), diffuses großzelliges B-Zell-Lymphom (DLBCL) (08/2018)
- Yescarta® (Axicabtagen ciloleucel): DLBCL; primäres mediastinales großzelliges B-Zell-Lymphom (PMBCL) (08/2018)
Quelle: IGES Institut nach Paul-Ehrlich-Institut (2018) und Europäische Arzneimittel-Agentur (2018)





























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.