
- DAZ.online
- News
- Spektrum
- Ein Gang durch die ...
150 Jahre Periodensystem der Elemente
Ein Gang durch die Entstehungsgeschichte dieser berühmtesten Tabelle der Welt
Hofheim am Taunus - 30.12.2019, 16:30 Uhr

Das Periodensystem der Elemente hat für das Verständnis der Chemie eine ähnliche fundamentale Bedeutung wie die Evolutionstheorie für die Biologie. (m / Foto: Tomasz Zajda / stock.adobe.com)
2019 wurde durch die UNESCO und die Generalversammlung der Vereinten Nationen das Jahr des Periodensystems der Elemente ausgerufen. Anlass ist das 150-jährige Jubiläum der ‚Erst‘beschreibung dieser Sequenz der chemischen Elemente. Anlass genug, sich die Entstehungsgeschichte der berühmtesten Tabelle der Welt einmal anzusehen.
Derzeit sind 118 chemische Elemente bekannt, die sich aufgrund ihrer elektrischen Leitfähigkeit unterteilen lassen in: Metalle - Halbmetalle - Nichtmetalle. Diese Klassifizierung sagt aber wenig aus über die weiteren sich periodisch ändernden Eigenschaften der Elemente und den sich daraus ableitenden Gesetzmäßigkeiten.
Bereits Anfang des 19. Jahrhunderts wurden vom Schotten William Prout und den deutschen Chemikern Wolfgang Döbereiner in Jena und Leopold Gmelin in Heidelberg erste Versuche unternommen, die zu ihrer Zeit bekannten 53 Elemente aufgrund ihrer Atommasse (Atomgewicht) zu ordnen. Um 1864 erkannte der Brite John A. R. Newlands, dass sich bei Anordnung der Elemente nach steigender Atommasse die chemischen Eigenschaften in jeder achten Position wiederholten. Er nannte seine Entdeckung das „Gesetz der Oktaven“, ein Vorläufer der heutigen Oktettregel, obwohl zur damaligen Zeit die Edelgase noch nicht bekannt waren.
Mehr zum Thema

Das Periodensystem der Elemente – eine pharmazeutische Würdigung des Jubilars
Happy Birthday, PSE!
Triadenregel bildete die wichtigste Grundlage
Die Triadenregel von Döbereiner bildete sicherlich die wichtigste Grundlage für das im Jahr 1869 von Dimitri Mendelejew (Russland) und Lothar Meyer (Deutschland) unabhängig voneinander entwickelte Periodensystem der Elemente (PSE) aufgrund steigender Atommassen. Dabei besitzt Mendelejew in der Fachwelt die größere Wertschätzung, weil er seine Anordnung nicht nur zur Voraussage neuer, noch unbekannter Elemente nutzte, sondern erstmals auch den Begriff der „Periodizität“ für die sich kontinuierlich ändernden Eigenschaften der chemischen Elemente prägte. Beide zusammen erhielten 1882 die von der britischen Royal Society verliehene Davy-Medaille, die damals höchste Auszeichnung für einen Chemiker.
Das Periodensystem der Elemente hat für das Verständnis der Chemie eine ähnliche fundamentale Bedeutung wie die Evolutionstheorie Darwins für die Biologie. Deshalb haben die Vereinten Nationen und die UNESCO das Jahr 2019 zum Jahr des PSE ausgerufen.
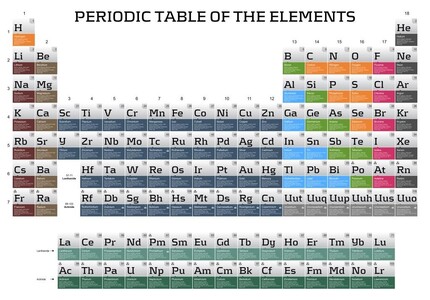
Das von Mendelejew skizzierte Periodensystem der Elemente (Abb.) motivierte den dänischen Quantenpionier Nils Bohr, sein nach ihm benanntes Atommodell zu entwickeln, weil er das Periodensystem der chemischen Elemente besser verstehen wollte.
Das PSE nach Mendelejew war somit auch – ausgehend vom Bohrschen Schalenmodell – die Geburtsstunde der Quantenchemie und führte schließlich dazu, dass heute die Ordnungszahl (Kernladungszahl) und damit auch in einem neutralen Atom die Elektronenzahl in der Atomhülle das bestimmende Ordnungsprinzip für die tabellarische Anordnung der Elemente darstellt (Abb.). Dies stimmt auch mit dem Elementbegriff überein, nach dem ein Element eine Ansammlung von Atomen ist, die alle die gleiche Zahl an positiv geladenen Protonen in ihrem Atomkern besitzen.
Ursache, die Kernladungszahl als Ordnungsprinzip zu wählen, war, dass die von Mendelejew entworfene Anordnung der Elemente nach steigender Atommasse an mehreren Stellen aufgrund der Eigenschaften des betreffenden Elements korrigiert werden musste. In der Regel ist die relative Atommasse des Elements zur rechten größer. Ausnahmen von dieser Regel nennt man Inversionen [Argon (Ar) vor Kalium (K) - Tellur (Te) vor Iod (I) - Cobalt (Co) vor Nickel (Ni) - Thorium (Th) vor Protactinium (Pa)].
























1 Kommentar
Artikel 150 Jahre PSE
von Claudia Christmann am 02.01.2020 um 17:52 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.