
- DAZ.online
- News
- Pharmazie
- Opioid-Sucht: EU-...
CHMP
Opioid-Sucht: EU-Zulassungsempfehlung für Buprenorphin-Implantat
Berlin - 29.04.2019, 14:00 Uhr
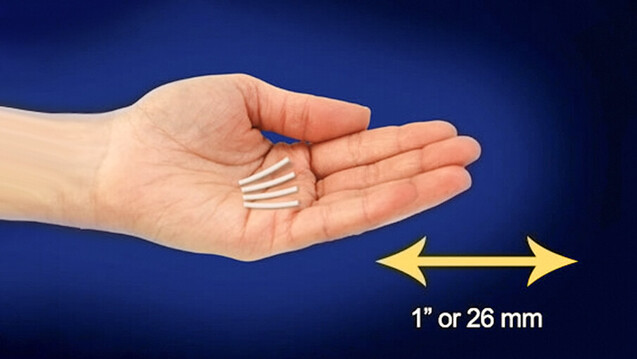
Die neue Subsitutionsmethode Sixmo soll stabile Patienten und Apotheker entlasten. ( r / Foto: Probuphine)
Für stabil eingestellte Opioidabhängige könnte sich die Substitutionsbehandlung demnächst vereinfachen: Der EMA-Ausschuss für Humanarzneimittel hat die Zulassung des Buprenorphin-Implantats Sixmo empfohlen, das über sechs Monate lang geringe Opioidmengen freisetzt.
Weniger Dokumentation für Apotheken, mehr Unabhängigkeit für Suchtpatienten – in Europa könnte künftig ein implantierbares Substitutionsarzneimittel für Opioidabhängige zur Verfügung stehen. Vergangene Woche hat der EMA-Ausschuss für Humanarzneimittel (CHMP) die Zulassung des Burphenophin-Implantats Sixmo empfohlen.
Aktualisierung: Die Europäische Kommission hat Sixmo am 19.06.2019 zugelassen.
Wirkstofffreisetzung über sechs Monate
Das Implantat enthält 74,2 Milligramm Wirkstoff, der über sechs Monate lang freigesetzt wird. Im Falle einer Zulassung ist das Produkt indiziert bei klinisch stabilen erwachsenen Patienten, die im Rahmen einer medizinischen, sozialen und psychologischen Behandlung nicht mehr als 8 Milligramm sublinguales Buprenorphin pro Tag benötigen.
In den USA ist das Implantat seit drei Jahren unter dem Namen Probuphin zugelassen. Es wurde von Titan Pharmaceuticals entwickelt und in den Staaten von der Firma Braeburn vertrieben. Der Handelspartner in der EU, der auch den Zulassungsantrag bei der EMA gestellt hat, ist das italienische Unternehmen L. Molteni & C. dei Fratelli Alitti Società di Esercizio.
Ziel: Sicherheit erhöhen, Compliance verbessern
Sixmo besteht aus vier kleinen Stäben, die von einem ausgebildeten Arzt unter örtlicher Betäubung in den Oberarm des Patienten implantiert werden. Anwendende Mediziner sollten Erfahrung mit kleinen ambulanten Eingriffen vorweisen können und auf die Produktanwendung geschult sein. Die subdermale Darreichungsform soll die Compliance verbessern und das Risiko von Überdosierungen oder Missbrauch verringern. Außerdem soll so vermieden werden, dass Kinder, die im Haushalt des Patienten leben, versehentlich ein opioidhaltiges Substitutionsarzneimittel einnehmen.
Implantat wirksamer als Sublingualtabletten
Die Wirksamkeit und Sicherheit des Implantats wurden in drei Zulassungsstudien mit insgesamt 626 erwachsenen Patienten untersucht. In einer der drei Studien mit 177 Opioidabhängigen, die von ihren behandelnden Ärzten als klinisch stabil eingestuft wurden, wurde die sublinguale mit der subdermalen Anwendung verglichen. Die Ergebnisse zeigten, dass 96,4 Prozent der Patienten in der Sixmo-Gruppe auf die Behandlung ansprachen, verglichen mit 87,6 Prozent der Patienten, die mit sublingualem Buprenorphin behandelt wurden. Auch die Abstinenzraten für Opioid-Beikonsum waren unter dem Implantat höher als unter der oralen Darreichungsform (85,7 versus 71, 9 Prozent).
Mehr zum Thema

Einfachere Opioidsubstitution mit Buvidal
Buprenorphin-Depot: nur einmal pro Woche oder Monat
Weitere Sicherheitsstudie gefordert
Die häufigsten unerwünschten Ereignisse im Zusammenhang mit diesem Arzneimittel waren Kopfschmerzen, Verstopfung und Schlaflosigkeit, welche auf den Wirkstoff zurückzuführen sind. Hinzu kamen lokale Nebenwirkungen aufgrund der Anwendung wie beispielsweise Schmerzen, starker Juckreiz und Hämatome an der Implantationsstelle. Der Antragsteller muss nun eine zusätzliche Studie durchführen, um die Risiken zu evaluieren, mit der Insertion und Entfernung der Implantate verbunden sind.
November 2018: Erstes Depot-Buprenorphin erhält EU-Zulassung
Mit dem Depot-Buprenorphin Buvidal® ist bereits eine nur wöchentliche oder monatliche Gabe von Buprenorphin möglich geworden. Die EU-Zulassung für Buvidal® erhielt Hersteller Camurus bereits im November 2018, seit Februar ist das Depot-Buprenorphin auch in Deutschland verfügbar. Buvidal® enthält Buprenorphin auf Basis einer Fluid-Crystal®-Technologie, die Verabreichung erfolgt ausschließlich ärztlich als subkutane Injektion.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.