Efpia will Studienprozesse
beschleunigen
Um die Attraktivität von Europa für klinische Studien
wieder zu steigern, präsentieren die europäischen Entscheider und Institutionen
zahlreiche Vorschläge. So plädiert die Efpia dafür, dass die Zulassungsbehörden
den Einreichungs- und Bewertungsprozess beschleunigen, um Europa wieder
attraktiver für klinische Tests zu machen. Und Christa Wirthumer-Hoche von der österreichischen
AGES sagt: „Damit wir hier wieder international aufholen, gibt es ein
Pilotprojekt, mit dem wir uns auf die neuen Herausforderungen durch die
EU-Verordnung einstellen und zeigen wollen, dass Österreich ein attraktiver
Forschungsstandort ist. Denn: Investitionen in die klinische Forschung sind
direkte Investitionen für die Patienten.“ Als Studienteilnehmer könnten diese
durch einen frühen Zugang zu innovativen Therapien von einer bestmöglichen medizinischer
Betreuung profitieren.
Auch jenseits des Atlantik trommelt die FDA für klinische
Studien in ihrem Einzugsbereich. Die Behörde möchte durch eine bessere
Informationspolitik vor allem verstärkt unterrepräsentierte Gruppen für die Pharmatests
gewinnen.
Einen speziellen Lösungsansatz bringt Median
Technologies-Managerin Hecht ins Gespräch: Ärzte könnten Patienten die
Teilnahme an klinischen Studien als eine von mehreren Therapieansätzen anbieten
– wohl wissend, dass es sich hierbei nicht um ausgereifte und zugelassene
Arzneimittel handelt.
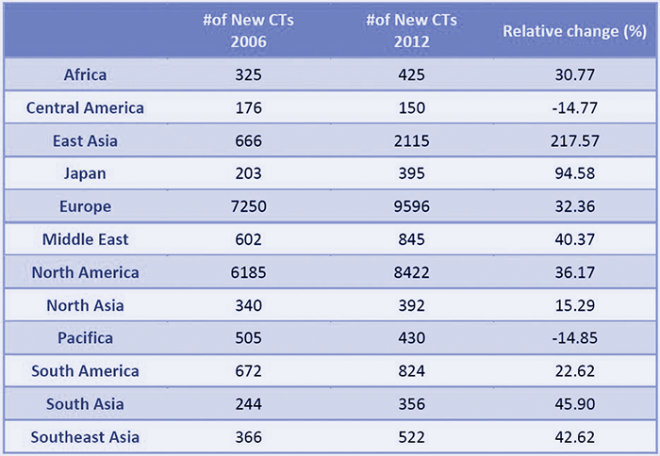
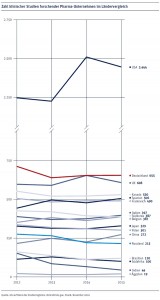
Trotz aller Internationalisierung klinischer Studien und des
negativen Trends in Europa wird der Kontinent auch in Zukunft eine bedeutende
Rolle bei derartigen Tests spielen. Darauf deutet laut Efpia auch die Tatsache
hin, dass die Zahl der Studienzentren in Europa steigt. Dies deutet nach Einschätzung
des Verbandes darauf hin, dass die Pharmaunternehmen nicht wirklich vorhaben,
ihre Studienaktivitäten in dieser Region weiter zu reduzieren.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.