
- DAZ.online
- News
- Apotheke
- Weitere ...
Bevorstehender Patentablauf
Weitere Generikahersteller bringen Lenalidomid-Präparate auf den Markt
Streichung erlaubt
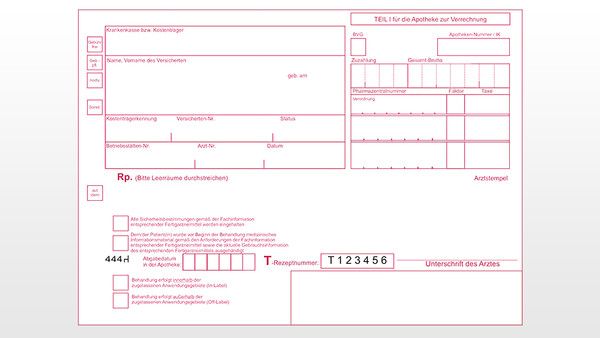
Bisher musste der Verordnende dem Anwender nach § 3a Absatz 2 Satz 1 AMVV unter anderem eine aktuelle Gebrauchsinformation des Fertigarzneimittels, das dieser erhalten soll, aushändigen und dies auf dem T-Rezept auch bestätigen. Allerdings sind Apotheken bekanntermaßen dazu verpflichtet, anstelle des verordneten Arzneimittels ein preisgünstiges Arzneimittel abzugeben, das mit dem verordneten in Wirkstärke und Packungsgröße identisch ist, für ein gleiches Anwendungsgebiet zugelassen ist und die gleiche oder eine austauschbare Darreichungsform besitzt. „Vor diesem Hintergrund wird durch die Neuregelung vermieden, dass die verschreibende Person dem Patienten oder der Patientin eine bestimmte Gebrauchsinformation auszuhändigen hat, obwohl sie nicht weiß, welches Fertigarzneimittel in der Apotheke aufgrund der genannten sozialrechtlichen Bestimmungen abgegeben werden wird“, heißt es im Besonderen Teil der Verordnung zur Änderung der AMVV.
Mehr zum Thema

Arzneimittelverschreibungsverordnung
Das ändert sich für T-Rezepte

DAZ-Fresh-up – was Apotheker wissen müssen
Die wichtigsten Fragen und Antworten zum T-Rezept

Teratogene Arzneimittel für Frauen
T-Rezepte: Wann sind Frauen gebärfähig?
Nötig wird daher eine Anpassung der T-Rezept-Formulare: Denn auf dem aktuell gültigen Formular bestätigt der Verordnende noch, unter anderem die Gebrauchsanweisung ausgehändigt zu haben. Das Bundesinstitut für Arzneimittel und Medizinprodukte erhält den Auftrag, die Formulare an die neuen Anforderungen anzupassen. Bis dahin dürfen Ärztinnen und Ärzte den Satzteil „… sowie die aktuelle Gebrauchsinformation des entsprechenden Fertigarzneimittels …“ einfach streichen. Die Änderung der AMVV wird am Tag nach ihrer Verkündung wirksam.
Unterschiede bei der Zulassung
Der Immunmodulator Lenalidomid ist strukturell verwandt mit den Wirkstoffen Thalidomid und Pomalidomid. Laut Revlimid®-Fachinformation ist er als Mono- und Kombinationstherapie zugelassen zur Behandlung von Menschen mit bestimmten Krebsarten, darunter multiples Myelom, Mantelzell-Lymphom, follikuläres Lymphom und myelodysplastische Syndrome. Bei den Generika gibt es jedoch aktuell noch Unterschiede, was die Zulassungen betrifft. Während etwa Lenalidomid AL bereits für das gesamte Indikationsspektrum zugelassen ist, darf Lenalidomid Stada zunächst nur zur Behandlung des multiplen Myeloms und des follikulären Lymphoms eingesetzt werden, informiert der Hersteller. Voraussichtlich im März soll auch die Zulassung für die beiden anderen Indikationen erfolgen.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.