
- DAZ.online
- News
- Pharmazie
- Eine mögliche neue Waffe...
Necroxime
Eine mögliche neue Waffe gegen Tumore aus dem Biss einer Spinne?
Düsseldorf - 09.03.2020, 09:00 Uhr

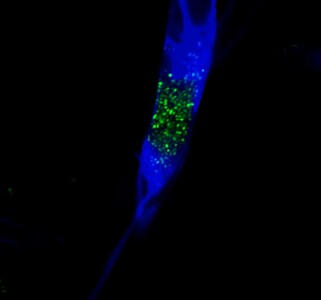
Forscher ausJena, des Hans-Knöll-Instituts (HKI) fanden als Endosymbionten lebende Bakterien, die sie als Produzenten einer ganzen Reihe von toxisch wirkenden Substanzen identifizierten. Pilz mit (links; 1. Spalte) und ohne bakterielle Endosymbionten (Foto: Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie)
Forscher des Leibniz-Instituts für Naturstoff-Forschung und Infektionsbiologie in Jena haben jetzt neue Wirkstoffe identifiziert, deren Ursprünge in den tragischen Folgen des Bisses einer australische Spinne liegen. Diese sogenannten Necroxime könnten wirksame Tumor-Therapeutika sein.
Manchmal entsteht aus großem Unglück dennoch etwas Positives. Im Falle einer Australierin, die in den 80er-Jahren des vergangenen Jahrhunderts nach dem Biss einer Spinne in ihren Finger als Folge den gesamten Unterarm durch eine folgende notwendige Amputation verlor, könnte das so sein – einiges spricht dafür, dass das persönliche Unglück der Frau dazu beitragen könnte, in Zukunft das Leben vieler Krebspatienten retten zu können.
Nach dem Spinnenbiss hatte sich bei der Frau eine fortschreitende Mischinfektion im Unterarm entwickelt, nur durch die Amputation hatte das Leben der Frau gerettet werden können. Im nekrotischen Gewebe des Unterarms fanden Forscher damals bereits einen Pilz, der mit dem Biss der Spinne übertragen wurde – Rhizopus microsporus. Der Pilz ist als Pflanzenpathogen von Reis bekannt und infiziert auch immungeschwächte Menschen. Außerdem wird er bei der Fermentation von Soja etwa zu Tempeh und Sufu genutzt.
Forscher des Leibniz-Instituts für Naturstoff-Forschung und Infektionsbiologie in Jena, des Hans-Knöll-Instituts (HKI), nahmen sich Proben dieses Pilzes vor einigen Jahren bereits vor und fanden darin wiederum in dem Pilz als Endosymbionten lebende Bakterien, die sie als Produzenten einer ganzen Reihe von toxisch wirkenden Substanzen identifizierten. Die gram-negativen Proteobakterien der Art Paraburkholderia rhizoxinica produzieren unter anderem eine Klasse von Mitose-Hemmern, die Rhizoxine, die als mögliche Tumor-Therapeutika erforscht wurden, allerdings wegen zu geringer in vivo-Aktivität nicht die klinische Phase erreichten. Rhizoxine sind Makrolaktone, die sich auch chemisch vollständig synthetisieren lassen – oder biotechnologisch durch das gut anzüchtbare Bakterium produziert werden können.
Necroxime bereits in kleinsten Mengen cytotoxisch und sehr tumorspezifisch
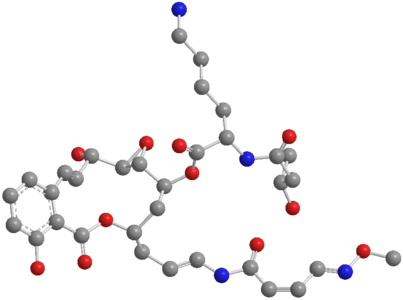
Nun konnten die Jenaer Forscher weitere Naturstoffe aus den Bakterien isolieren und dabei auch deren Biosynthese vollständig aufklären. Die Klasse der Necroxime sind Benzolacton-Enamide – große ringförmige organische Makromoleküle - und wirken laut der Forscher bereits in kleinsten Mengen cytotoxisch.
„Die Necroxime wirken vor allem recht spezifisch gegen Tumorzellen“, erklärt Sarah Niehs, wissenschaftliche Mitarbeiterin und Doktorandin in der Forschungsgruppe von Professor Dr. Christian Hertweck in der Abteilung Biomolekulare Chemie des Instituts – und Erstautorin des in der Fachzeitschrift Angewandte Chemie veröffentlichten Artikels. Der Wirkmechanismus verwandter Substanzen sei dabei zum Teil bekannt, sagt die Forscherin. „Die Substanzen interagieren mit den vakuolären H+-ATPasen. Tumorzellen müssen den pH ihrer Umgebung ganz genau steuern, um schnell wachsen zu können. Dazu werden unter anderem die V-ATPasen verwendet. Werden diese Proteine gehemmt, betrifft es also vorwiegend Tumorzellen“, erklärt Niehs.
V-ATPasen sind dabei in der Membran von Vakuolen vorhandene Transportproteine, die unter Verbrauch von ATP – Adenosintriphosphat, dem Energieträger zellulärer Vorgänge – Protonen transportieren. Deren Konzentration wiederrum bestimmt den „Säuregrad“ also den pH-Wert eines wässrigen Mediums.
„Diese Benzolacton-Enamide wirken dabei recht spezifisch gegen Tumorzellen. Modifikationen der Seitenkette am Makrolaktonring könnten aber zu noch gezielteren Wirkungen führen“, sagt die Doktorandin. Bislang habe man vier Necroxime identifiziert, die sich vom gleichen Biosyntheseweg ableiten ließen. „Der Unterschied besteht in einer der Seitenketten am Makrolaktonring. Entweder wurde eine Hydroxygruppe entfernt wie beim Necroxim B oder die gesamte Seitenkette fehlt wie bei den Necroximen C und D. Bei letzterem besteht der Unterschied in der Molekülstruktur nur in der Ausrichtung einer Doppelbindung“, erklärt Niehs.
Molekül-Struktur und Biosyntheseweg aufgeklärt
Die Jenaer Forscher klärten nicht nur die Struktur und die Biosynthese in Paraburkholderia rhizoxinica auf, sondern konnten auch mittels bioinformatischen Methoden Gene für die Produktion von Benzolaktonen in diversen Bakterien identifizieren. „Die Biosynthesewege der Necroxime und verwandter Substanzen waren bislang vollkommen unbekannt. Wir konnten dabei ein enzymatisches ‚Fließbandsystem‘ identifizieren, bei dem molekulare Grundbausteine des Zellstoffwechsels - wie etwa Malonyl-CoA mit Aminosäuren oder weiteren Malonyl-Bausteinen - nach einem festgelegten Programm zu einer Kette verknüpft werden. Später erfolgen dann weitere Modifikationen wie etwa der Ringschluss des Makrolaktons“, sagt Niehs.
Die Forscher sehen die Aufklärung der Biosynthese-Schritte nun als eine Möglichkeit, die Biosynthese auch gezielt umzuprogrammieren, um modifizierte Wirkstoffe biotechnologisch produzieren zu können. „Necroxime können in großem Maßstab biotechnologisch produziert werden. Eine Überproduktion in Paraburkholderia rhizoxinica kann mittels genetischer Manipulation erreicht werden“, sagt die Forscherin. Ein Transfer des Biosynthesewegs in andere Bakterien sei allerdings schwierig.
Noch viel Forschung nötig bis zum Therapeutikum
Bis Necroxime allerdings in der Tumor-Therapie tatsächlich zum Einsatz kommen, könnten durchaus noch zehn bis 20 Jahre vergehen. Zunächst habe man nun die Wirkstoffklasse identifiziert und ihr Potenzial für die Tumor-Behandlung erkannt. „Es erfordert aber noch weitere Studien wie etwa die Modifikation der Moleküle und die Erforschung des exakten Wirkmechanismus, um einer Weiterentwicklung als Tumor-Therapeutikum in Betracht zu ziehen“, sagt die Wissenschaftlerin. Derzeit werde in anderen Forschungsgruppen weltweit auch viel an potenziellen anderen V-ATPase-Inhibitoren geforscht.
Die Jenaer Forscher wollen als nächstes weitere Details der ungewöhnlichen Biosynthese aufklären, sagt Niehs. „Uns am HKI ist außerdem wichtig, die ökologische Rolle der Necroxime zu entziffern. Warum werden sie biosynthetisiert? Welchen Vorteil hat das Bakterium oder der Pilz, in dem die Bakterien leben, davon?“, sagt sie.
Die „chemische Sprache in Organismengemeinschaften“ ist einer der Forschungsschwerpunkte der Forschungsgruppe Hertweck, den sie im Sonderforschungsbereich „ChemBioSys“ erkunden. „Das komplexe Zusammenleben unterschiedlicher Organismen – hier Bakterium, Pilz und Spinne – wird größtenteils von chemischen Substanzen gesteuert. Mit den Necroximen haben wir neue toxische Naturstoffe entdeckt, die möglicherweise auch nutzbringend für den Menschen zum Einsatz kommen könnten“, sagt Hertweck dazu.
Die Veröffentlichung der Jenaer Forscher ist im Fachmagazin Angewandte Chemie erschienen unter: Niehs SP, Dose B, Richter R, Pidot SJ, Dahse H-M, Stinear TP, Hertweck C (2020) Mining symbionts of spider‐transmitted fungus illuminates uncharted biosynthetic pathways to cytotoxic benzolactones. Angewandte Chemie International Edition https://doi.org/10.1002/anie.201916007 (https://doi.org/10.1002/anie.201916007).





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.