
- DAZ.online
- News
- Pharmazie
- Diese Arzneimittel kö...
Krebs, Gentherapie und Antibiotika
Diese Arzneimittel könnten 2018 auf den Markt kommen
Stuttgart - 10.01.2018, 09:30 Uhr

30 neue Arzneimittel werden für das Jahr 2018 erwartet. (Foto: lily / stock.adobecom)
Nach Schätzungen des Verbandes der forschenden Pharmaunternehmen (vfa) könnten in diesem Jahr mindestens 30 Arzneimittel mit neuem Wirkstoff beziehungsweise neuem Therapieprinzip zugelassen werden. Davon soll ein Drittel der Behandlung von Krebserkrankungen dienen und ein weiteres Drittel bei seltenen Erkrankungen angewendet werden. Weitere Therapiefelder der neuen Substanzen sind bakterielle Infektionserkrankungen und Gerinnungsstörungen.
Die neuen Krebsarzneimittel richten sich unter anderem gegen Leukämie, Lymphknoten-, Brust- und Eierstockkrebs. Von den 18 bei der EMA eingereichten Onkologika-Zulassungen erhielten drei Substanzen (MAbp1 von XBiotech, Masitinib mesylat von ABScience und Plitidepsin von PharmaMar) bereits ein negatives CHMP-Votum, wogegen aber noch Widerspruch möglich ist. Unter den Anträgen, bei denen die medizinische Bewertung noch aussteht, befinden sich fünf personalisierte Krebs-Therapien, davon zwei gegen Mammakarzinome. Zwei weitere Onkologika gehören zu dem recht jungen Forschungsfeld der individuellen Therapien.
Personalisierte Brustkrebstherapien
Das personalisierte neue Brustkrebsmittel Neratinib (Nerlynx®) wurde gegen HER-2 (human epidermal growth factor receptor 2) positive Mammakarzinome entwickelt. Zwanzig Prozent der Brustkrebspatientinnen sind HER-2 positiv, was mit einem aggressiveren Krankheitsverlauf verbunden ist. Vor Anwendung der künftigen Therapien ist deshalb ein HER-2 Test erforderlich, weshalb sie als personalisiert bezeichnet werden. Neratinib soll zur adjuvanten Behandlung vorbehandelter Patientinnen im Frühstadium eingesetzt werden und wurde im Juli 2017 in den USA zugelassen. Die Zulassungsstudie mit 2840 Patientinnen zeigte eine Steigerung des rezidiv-freien Anteils nach zwei Jahren von 91,9 auf 94,2 Prozent.
Der Inhibitor der Cyclin-abhängigen Kinase Abemaciclib (Verzenio®)* von Lilly ist zur Behandlung von postmenopausalen Patientinnen mit fortgeschrittenem oder metastasiertem Brustkrebs mit HER-2 negativem* oder HR (Hormonrezeptor) positivem Befund vorgesehen. Die Substanz erhielt bereits 2015 von der FDA aufgrund der Phase I Studie den Breakthrough-Status, bei der EU wurde Abemaciclib erst im August 2017 eingereicht. In dem Phase-III-Programm wurde Abemaciclib sowohl in Kombination mit Fulvestrant als auch mit einem nicht-steroidalen Aromatase-Inhibitor (Anastrozol oder Letrozol) untersucht.
* Anmerkung der Redaktion: In der früheren Version des Artikels hieß es fälschlicherweise HER-2 positiv. Wir bitten diesen Fehler zu entschuldigen.
Individuelle Therapieansätze
Die Anwendung der beiden individuellen Therapieverfahren dürfte vorerst spezialisierten Zentren vorbehalten sein. Dabei wird biologisches Material entnommen, im Labor verändert und dem Patienten zurückgeführt, wo sich die modifizierten Zellen spezifische Wirkungen gegen sein individuelles Krankheitsbild entfalten.
Gegen akute lymphatische Leukämie hat Novartis eine Gentherapie unter dem Namen Kymriah® entwickelt. Dem Patienten werden T-Zell-Lymphozyten entnommen, in die mit Hilfe eines Virus ein chimärischer Antigen-Rezeptor (CAR) eingebaut wird, der Leukämiezellen erkennen kann. Die so veränderten Lymphozyten werden im Labor vermehrt, dem Patienten zurückgeführt und leiten dort die Zerstörung der Blutkrebszellen ein. In der offenen Phase II Studie ELIANA mit Patienten zwischen drei und 27 Jahren, die auf andere Therapien nicht angesprochen hatten, erreichten von 63 behandelten Patienten 52 eine Remission, die in 40 Prozent der Fälle komplett war. Als schwere Nebenwirkung kam es bei 63 Prozent zu einem „cytokine release syndrome“, eine schwere, potenziell lebensbedrohliche Immunreaktion. Da bisher kontrollierte Vergleichsstudien fehlen, ist die Abschätzung des Nutzen-Risikopotenzials noch abzuwarten. Die Zulassung in den USA erfolgte im September 2017, in der EU wurde der Antrag vergangenen November eingereicht.
Die zweite individuelle Krebstherapie wurde als
Begleitbehandlung bei hämatopoetischer Stammzelltransplantation im Rahmen
verschiedener Blutkrebserkrankungen mit dem Ziel entwickelt,
Abstoßungsreaktionen zu vermeiden. Die Stammzellen des Spenders werden ex vivo mit
Patientenzellen und dem phototoxischen Wirkstoff TH9402 gemischt. In den
Spender-T-Zellen, welche sich bei Transfusion sonst gegen den Empfänger richten
würden (graft-versus-host-reaction), reichert sich das Phototoxin an. Durch Bestrahlung mit Licht der Wellenlänge,
welche TH9402 aktiviert, werden die aktivierten Spender T-Zellen vernichtet. Das
Biotech-Unternehmen Kiadis hat das Verfahren ATIR-101 bei der EU im Mai 2017
eingereicht.
Blutgerinnung
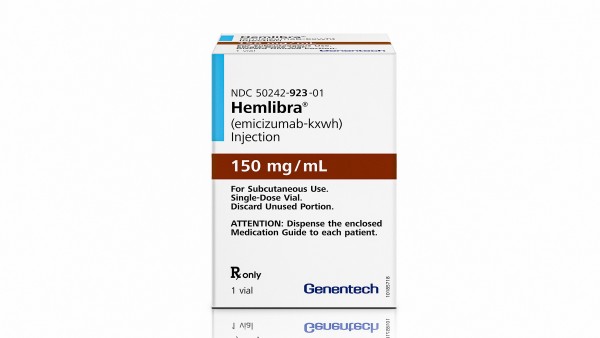
Patienten mit der Gerinnungsstörung Hämophilie A könnte bald der neue Antikörper Emicizumab (Roche) zur Verfügung stehen. Die Substanz übernimmt die Rolle des natürlichen Gerinnungsfaktors VIII, der bei Hämophilie A Patienten unzureichend gebildet wird. Der Vorteil gegenüber der klassischen Faktor VIII-Substitution liegt darin, dass sich die Struktur von Emicizumab strukturell vom Faktor VIII unterscheidet und deshalb nicht von neutralisierenden Antikörpern des Patienten erkannt wird. Unter der Faktor-VIII-Ersatztherapie kommt es nämlich bei 30 Prozent der Patienten zur Antikörperbildung gegen den zugeführten Faktor VIII (Hemmkörperhämophilie), wodurch die Wirksamkeit nachlässt und lebensbedrohliche Blutungen auftreten können.
Eine weitere Substanz, die schon seit längerem in der
Pipeline liegt, soll die Wirkung von Antikoagulanzien aufheben, die sich gegen
den Gerinnungsfaktor Xa richten (Heparine, Rivaroxaban, Apixaban, Edoxaban).
Nachdem Boehringer gegen den direkten Thrombininhibitor Dabigatran (Pradaxa®)
seit Anfang 2016 das Antidot Praxbind®
zur Verfügung gestellt hat, häufen sich die Anfragen nach einem Antidot für die
anderen Gerinnungshemmer. Das in San Francisco ansässige Spezialunternehmen
Portola Pharmaceuticals hat mit Andexanet-alfa ein gemeinsames Antidot für die
Xa-Hemmer entwickelt und die auf dem ANNEXA-Programm basierende Zulassung bereits
vor einiger Zeit eingereicht. Die FDA hat kürzlich um einen
Aufschub von 90 Tagen zur Bewertung gegeben, die im kommenden Mai erwartet wird.
Die EMA-Entscheidung soll ebenfalls in der ersten Jahreshälfte 2018 fallen.
Neue Antibiotika
Die Resistenzbildung gegen Antibiotika fordert die Heilberufe ständig neu heraus. Zwei der neuen sich im EU-Zulassungsverfahren befindlichen Antiinfektiva richten sich gegen multiresistente Keime. Das Fluorocyclin-Antibiotikum Eravacyclin wurde von Tetraphase Pharmaceuticals gegen komplizierte Bauchraum- und Harnwegsinfektionen entwickelt. Das Spektrum umfasst unter anderem Methicillin-resistente Staphylokokken, Vancomycin-resistente Enterokokken, Carbapenem-resistente Klebsiellen und auch Tetracyclin-resistente Keime. Im Gegensatz zu Colistin oder Polymixin soll das neue Tetracyclin-Derivat weniger toxisch sein und kann höher dosiert werden.
Die Kombination aus Meropenem und dem neuen ß-Lactamase-Inhibitor Vaborbactam von Rempex Pharmaceutica ist schon in den USA als Reserve-Antibiotikum bei Patienten mit komplizierten Harnwegsinfektionen unter dem Namen Vabomere® zugelassen. Der Kombinationspartner Vaboractam inaktiviert Klebsiella-pneumoniae-Carbapenemasen, die für die Resistenz von Enterobakterien gegen Carbapenem verantwortlich sind.
Seltene Erkrankungen
In der Europäischen Union gilt eine Erkrankung als selten, wenn nicht mehr als fünf von 10.000 Menschen betroffen sind. Doch der Begriff „selten“ ist relativ angesichts der Tatsache, dass es nach Information des Bundesministeriums für Gesundheit 8000 Erkrankungen dieser Definition gibt. In Deutschland leben etwa vier Millionen Menschen mit sehr unterschiedlichen seltenen Erkrankungen (orphan diseases). Die Zulassung von Arzneimitteln gegen seltene Erkrankungen unterliegen bei den Behörden einem speziellen Verfahren. Gemäß den Angaben des vfa könnten 2018 neue Medikamente gegen Morbus Wilson, Mukopolysaccharidose VII, eine bestimmte Form der Mukoviszidose, sowie gegen seltene Krebserkrankungen wie das multiple Myelom zur Verfügung stehen.
Im Oktober vergangenen Jahres hat die EMA beispielsweise einer neuen Gentherapie gegen Morbus Wilson, die an der molekularen Ursache der Kupferspeicherkrankheit angreift, den Orphan-Drug-Status zugesprochen. Bei Wilson-Patienten liegt ein Gendefekt des Kupfer transportierenden Enzyms P-Typ-ATPase (ATP7B) vor, wodurch sich das Metall in toxischen Mengen in den Leberzellen anhäufen kann. Der adeno-assoziierte Virus VTX-801 von Vivet Therapeutics soll das fehlende Gen für den Kupfertransporter zu den Leberzellen transportieren. Bislang liegen jedoch keine klinischen Studien mit Patienten vor.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.