
- DAZ.online
- News
- Pharmazie
- Diese Arzneimittel kö...
Krebs, Gentherapie und Antibiotika
Diese Arzneimittel könnten 2018 auf den Markt kommen
Stuttgart - 10.01.2018, 09:30 Uhr

30 neue Arzneimittel werden für das Jahr 2018 erwartet. (Foto: lily / stock.adobecom)
Individuelle Therapieansätze
Die Anwendung der beiden individuellen Therapieverfahren dürfte vorerst spezialisierten Zentren vorbehalten sein. Dabei wird biologisches Material entnommen, im Labor verändert und dem Patienten zurückgeführt, wo sich die modifizierten Zellen spezifische Wirkungen gegen sein individuelles Krankheitsbild entfalten.
Gegen akute lymphatische Leukämie hat Novartis eine Gentherapie unter dem Namen Kymriah® entwickelt. Dem Patienten werden T-Zell-Lymphozyten entnommen, in die mit Hilfe eines Virus ein chimärischer Antigen-Rezeptor (CAR) eingebaut wird, der Leukämiezellen erkennen kann. Die so veränderten Lymphozyten werden im Labor vermehrt, dem Patienten zurückgeführt und leiten dort die Zerstörung der Blutkrebszellen ein. In der offenen Phase II Studie ELIANA mit Patienten zwischen drei und 27 Jahren, die auf andere Therapien nicht angesprochen hatten, erreichten von 63 behandelten Patienten 52 eine Remission, die in 40 Prozent der Fälle komplett war. Als schwere Nebenwirkung kam es bei 63 Prozent zu einem „cytokine release syndrome“, eine schwere, potenziell lebensbedrohliche Immunreaktion. Da bisher kontrollierte Vergleichsstudien fehlen, ist die Abschätzung des Nutzen-Risikopotenzials noch abzuwarten. Die Zulassung in den USA erfolgte im September 2017, in der EU wurde der Antrag vergangenen November eingereicht.
Die zweite individuelle Krebstherapie wurde als
Begleitbehandlung bei hämatopoetischer Stammzelltransplantation im Rahmen
verschiedener Blutkrebserkrankungen mit dem Ziel entwickelt,
Abstoßungsreaktionen zu vermeiden. Die Stammzellen des Spenders werden ex vivo mit
Patientenzellen und dem phototoxischen Wirkstoff TH9402 gemischt. In den
Spender-T-Zellen, welche sich bei Transfusion sonst gegen den Empfänger richten
würden (graft-versus-host-reaction), reichert sich das Phototoxin an. Durch Bestrahlung mit Licht der Wellenlänge,
welche TH9402 aktiviert, werden die aktivierten Spender T-Zellen vernichtet. Das
Biotech-Unternehmen Kiadis hat das Verfahren ATIR-101 bei der EU im Mai 2017
eingereicht.
Blutgerinnung
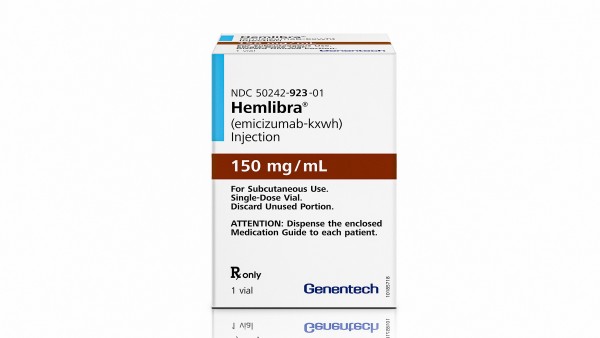
Patienten mit der Gerinnungsstörung Hämophilie A könnte bald der neue Antikörper Emicizumab (Roche) zur Verfügung stehen. Die Substanz übernimmt die Rolle des natürlichen Gerinnungsfaktors VIII, der bei Hämophilie A Patienten unzureichend gebildet wird. Der Vorteil gegenüber der klassischen Faktor VIII-Substitution liegt darin, dass sich die Struktur von Emicizumab strukturell vom Faktor VIII unterscheidet und deshalb nicht von neutralisierenden Antikörpern des Patienten erkannt wird. Unter der Faktor-VIII-Ersatztherapie kommt es nämlich bei 30 Prozent der Patienten zur Antikörperbildung gegen den zugeführten Faktor VIII (Hemmkörperhämophilie), wodurch die Wirksamkeit nachlässt und lebensbedrohliche Blutungen auftreten können.
Eine weitere Substanz, die schon seit längerem in der
Pipeline liegt, soll die Wirkung von Antikoagulanzien aufheben, die sich gegen
den Gerinnungsfaktor Xa richten (Heparine, Rivaroxaban, Apixaban, Edoxaban).
Nachdem Boehringer gegen den direkten Thrombininhibitor Dabigatran (Pradaxa®)
seit Anfang 2016 das Antidot Praxbind®
zur Verfügung gestellt hat, häufen sich die Anfragen nach einem Antidot für die
anderen Gerinnungshemmer. Das in San Francisco ansässige Spezialunternehmen
Portola Pharmaceuticals hat mit Andexanet-alfa ein gemeinsames Antidot für die
Xa-Hemmer entwickelt und die auf dem ANNEXA-Programm basierende Zulassung bereits
vor einiger Zeit eingereicht. Die FDA hat kürzlich um einen
Aufschub von 90 Tagen zur Bewertung gegeben, die im kommenden Mai erwartet wird.
Die EMA-Entscheidung soll ebenfalls in der ersten Jahreshälfte 2018 fallen.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.