
- DAZ.online
- News
- Politik
- Neuer Rechtsrahmen für ...
BAH im Dialog
Neuer Rechtsrahmen für Medizinprodukte kurz vor dem Abschluss
Berlin - 30.09.2016, 16:00 Uhr

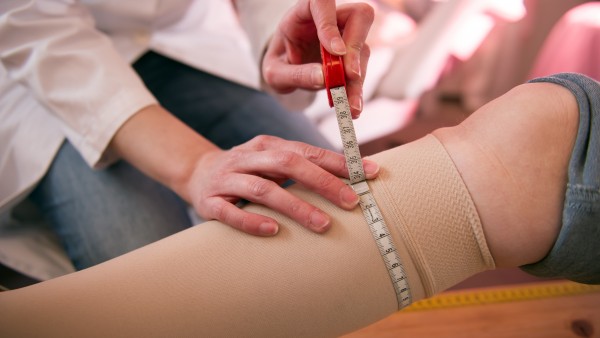
Elmar Kroth (BAH), Jörg Wilke (ecm-Zertifizierungsgesellschaft für Medizinprodukte in Europa mbH), Guido Middeler (Diapharm), Gesine Meißner (MdEP), Hubertus Cranz (AESGP) und William Shang (Johnson & Johnson) diskutierten die kommenden Neuerungen Medizinprodukterecht. (Foto: BAH/ Pietschmann)
Die neue EU-Regulierung für Medizinprodukte war ein langwieriger und zäher Prozess. Nun ist der Schlussspurt in Sicht. Eine Diskussionsrunde beim BAH im Dialog in Berlin beleuchtete das Ergebnis und die Konsequenzen für die Unternehmen.
Vier
Jahre lang haben die europäischen Gesetzgeber und die Stakeholder um die rund
350 Seiten der neuen Verordnung über Medizinprodukte gerungen, bevor nun
endlich ein Kompromiss erzielt werden konnte.
Gesine Meissner, Abgeordnete des Europäischen Parlaments (FDP), die am 29. September bei einer Dialogveranstaltung des Bundesverbandes der Arzneimittel-Hersteller (BAH) in Berlin mit einem Impulsvortrag in die Thematik einführte, sagte: „Das ist das komplizierteste Gesetzgebungsverfahren, mit dem ich je zu tun hatte.“ Sie hat den Prozess als sogenannte „Schatten-Berichterstatterin“ ihrer Fraktion im Europäischen Parlament maßgeblich mit begleitet und weiß deswegen sehr gut, wovon sie spricht. Die finale Abstimmung im Rat ist nun für den 17. Februar 2017 anberaumt. Meissner rechnet damit, dass die Texte – parallel dazu gibt es auch eine neue Verordnung über In vitro-Diagnostika – im März 2017 veröffentlicht werden.
Konsequenzen für stoffliche Medizinprodukte
Den breitesten Raum nahmen bei der Podiumsdiskussion die stofflichen Medizinprodukte ein. Das sind Produkte, die von der Aufmachung her vielfach wie Arzneimittel „daher kommen“, aber nicht unter die Definition eines Arzneimittels oder auch eines Kosmetikums fallen, wie etwa Macrogol-Präparate, Meersalz-Nasenspray und Hyaluronsäure-haltige Lutschpastillen. Sie werden nun mit der neuen EU-Verordnung in höhere Risikoklassen umgestuft und damit zum Teil auf eine Stufe zum Beispiel mit Produkten wie Herzschrittmachern gestellt. Damit müssen sie zum einen von einer Benannten Stelle zertifiziert werden. Zum anderen müssen die Hersteller Wirksamkeitsnachweise und Studien zur Sicherheit vorlegen.
Guter Kompromiss gefunden
Die Bedeutung der stofflichen Medizinprodukte war im frühen Gesetzgebungsverfahren zunächst nicht gebührend erkannt worden. „Das Verständnis für diese Kategorie ist erst durch die intensiven Diskussionen in den letzten Jahren gewachsen“, betonte der Generaldirektor des Europäischen Dachverbandes für die Selbstmedikation AESGP Hubertus Cranz. Im Vergleich zu den ersten Überlegungen der EU-Kommission, sie komplett aus dem Medizinprodukterecht heraus zu nehmen, konnte aus seiner Sicht nun ein sachgerechter Kompromiss gefunden werden.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.