
- DAZ.online
- News
- Zulassungsverfahren für ...
Industrie- versus Patienteninteressen
Zulassungsverfahren für Medizinprodukte in der Kritik
Medizinprodukte lassen immer neue Behandlungsansätze zu, sie werden innovativer und komplexer. Aber sind sie auch sicher? Nach Auffassung des GKV-Spitzenverbands sind die aktuellen Regeln zum Verkauf und zur Anwendung von Medizinprodukten nicht strikt genug: „Patientensicherheit ist wichtiger als Wirtschaftsinteressen“, erklärte die Vorstandsvorsitzende Doris Pfeiffer am Mittwoch in Berlin.
Die Hauptforderung des Verbands: Für Hochrisiko-Medizinprodukte sollte es ein behördliches Zulassungsverfahren geben. Damit käme der Wettbewerb zwischen den 80 Benannten Stellen in Europa, die für die Zertifizierung der Medizinprodukte zuständig sind, zum Erliegen. Wie Matthias Dettloff aus der Abteilung Medizin beim GKV-Spitzenverband erklärte, darf sich nur eine Benannte Stelle mit der Zulassung eines Medizinproduktes befassen. Zuvor kann natürlich unverbindlich bei mehreren Stellen nachgefragt werden, welche Kosten auf den Hersteller bei einer Beauftragung zukommen würden. „Die Preisspanne ist sehr heterogen“, sagte Dettloff – sie liege zwischen 3.500 und 50.000 Euro.
Abgesehen vom geforderten amtlichen Zulassungsverfahren sollte es nach Auffassung des Verbands auch obligatorische klinische Prüfungen zum Nachweis der Wirksamkeit im Vergleich zum medizinischen Standard geben. In Sachen Transparenz müsse sich ebenfalls noch mehr tun – so sollte die Dokumentation von Zulassungsbescheiden, zugelassenen Indikationen, klinischen Prüfungen und Ergebnissen etc. transparenter werden. Und Vorkommnisse sollten zentral in einer europäischen Behörde erfasst und ausgewertet werden – für die Durchsetzung der Meldepflicht wäre die Möglichkeit der Sanktionierung erforderlich.
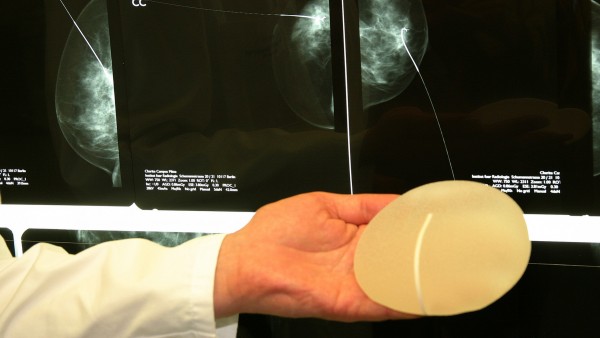
Mit Nachdruck verwies Pfeiffer zudem auf ein neuerliches Projekt des British Medical Journal. Redakteure des Fachblattes hatten sich gemeinsam mit Redakteuren des Daily Telegraph als ein Hersteller künstlicher Hüftgelenke ausgegeben und wollten für ein neues Hüftgelenk die Zulassung beantragen. Aus den Unterlagen zum fiktiven Hüftgelenk ging hervor, dass es giftige Metallionen absonderte. Dennoch erklärte die Mehrheit der 14 angeschriebenen Zertifizierungsstellen, das eingereichte Dossier reiche zur Bewilligung für Europa aus. Man sei „auf der Seite der Hersteller“, erklärte der Mitarbeiter einer Benannten Stelle gegenüber den Redakteuren. Patientensicherheit sei jedoch wichtiger als Wirtschaftsinteressen, betonte Pfeiffer. Und es sollten auch keine weiteren Skandale – wie der um die PIP-Brustimplantate – erforderlich sein, um die Politik zum Handeln zu bewegen.
Lesen Sie zum Thema auch:
Medizinprodukte in der EU: Kassen fordern zentrales Zulassungsverfahren
Europäische Kommission: Schärfere Kontrollen nach Brustimplantate-Skandal
























Berlin - 07.11.2012, 14:41 Uhr