
- DAZ.online
- News
- Rückruf für orale ...
Periphere arterielle Verschlusskrankheit
Rückruf für orale Buflomedil-Präparate steht bevor
Ende letzter Woche hatte die Europäische Arzneimittelagentur (EMA) im Rahmen einer Bewertung des Vasodilatators Buflomedil den Mitgliedsstaaten empfohlen, alle Präparate zur oralen Anwendung vom Markt zu nehmen. Als Reaktion auf diese Empfehlung
Buflomedil ist ein Vasodilatator, der bei peripherer arterieller Verschlusskrankheit eingesetzt wird. Er soll die Fließeigenschaften des Blutes verbessern und damit unter anderem die schmerzfreie Gehstrecke verlängern. Hintergrund für die EMA-Empfehlung, Buflomedil vom Markt zu nehmen, ist ein negatives Nutzen-Risiko-Verhältnis, das der zuständige Ausschuss für Humanarzneimittel (CHMP) nach Sichtung der Daten festgestellt hat. Insbesondere bei Überdosierung könne es zu schweren neurologischen und kardialen Nebenwirkungen kommen, teilweise mit tödlichem Verlauf, so die Begründung. Auf der anderen Seite soll der Nutzen, gemessen in Form der schmerzfreien Gehstrecke, gering sein. Die parenterale Buflomedil-Anwendung wird zurzeit noch durch den Ausschuss für Humanarzneimittel (CHMP) der EMA bewertet. Eine abschließende Stellungnahme wird dann zusammen mit der jetzt bekannt gegebenen Empfehlung für orale Zubereitungen veröffentlicht werden.
Auf Nachfrage von DAZ.online teilte das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) mit, dass es aufgrund der Zwischenempfehlung in den nächsten Tagen das Ruhen der Zulassung für alle noch im Markt befindlichen oralen Buflomedil-Zubereitungen anordnen werde, so dass in Kürze mit einem Rückruf zu rechnen ist.






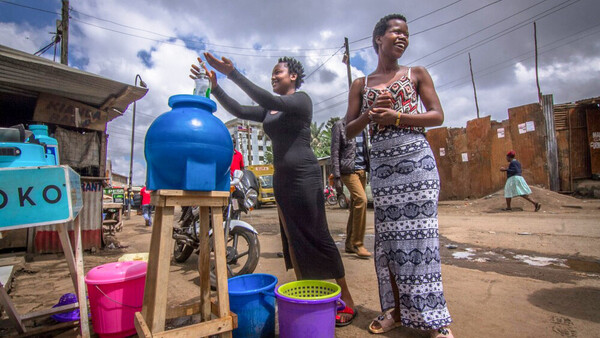
















23.05.2011, 12:43 Uhr