
- DAZ.online
- News
- Spektrum
- Was aus den chinesischen ...
Strengere Gesetze?
Was aus den chinesischen Pharmaskandalen des Sommers wurde
Stuttgart - 26.10.2018, 15:15 Uhr
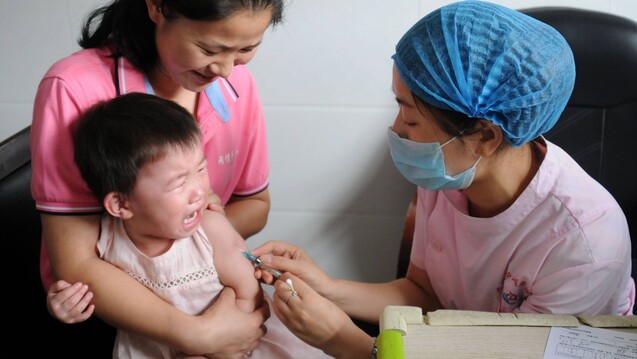
Wirkungslose Tollwutimpfstoffe waren im Sommer 2018 nicht der einzige Pharmaskandal in China. Welche Konsequenzen folgten? (Foto: imago)
China prüft strengere Gesetze gegen Arzneimittelfälschungen
Am 22. Oktober vermeldete Xinhua nun, dass China derzeit an strengeren Gesetzen gegen Arzneimittelfälschungen arbeite. Demnach hat China am vergangenen Montag damit begonnen, einen Entwurf zur Änderung des Arzneimittelgesetzes zu prüfen. Die Änderungen sollen härtere Strafen vorsehen: Wer ohne Erlaubnis Arzneimittel herstellt, soll dem Entwurf zufolge in Zukunft mit Geldstrafen belegt werden können, die das Fünf- bis 30-fache des Verdienstes betragen – aktuell sollen sich Geldstrafen nur auf das Zwei- bis Fünffache belaufen.
Mehr zum Thema

Verunreinigungen in Valsartan
Kompromisslos der Qualität verpflichtet – unabhängig vom Produktionsstandort?
Der Gesetzentwurf folgt mit einer Woche Abstand auf die Geldstrafe, die gegen den Impfstoffhersteller Changchun Changsheng verhängt wurde. Dementsprechend werden laut Xinhua auch die Verwaltung und Überwachung von Impfstoffen im Entwurf besonders hervorgehoben: Impfstoffe, Blutprodukte und Anästhetika würden als Spezialarzneimittel definiert, die nicht für die Lohnfertigung zugelassen sind. Zudem werde von den Zulassungsinhabern der Impfstoffe verlangt, dass sie ihre Produkte pflichtversichern.
Arzneimittelüberwachung soll erweitert werden
Die Arzneimittelüberwachung insgesamt soll nicht nur verschärft, sondern auch erweitert werden – auf die Rohstoffversorgung, Herstellung und Vorverkaufsprüfung. Der Entwurf führt dem Bericht zufolge einen Mechanismus zur vollständigen Rückverfolgbarkeit und ein Rückrufsystem ein. Hersteller, die Arzneimittelsicherheitsrisiken nicht erkennen oder beseitigen, sollen von der Produktion und dem Verkauf ausgeschlossen werden. Außerdem wird ein Arzneimittelsicherheitssystem vorgeschlagen, mit dem entsprechende Informationen rechtzeitig aktualisiert und veröffentlich werden sollen – beispielsweise Herstellungserlaubnisse, Ergebnisse täglicher Inspektionen und Verstöße.
Forschungseinrichtungen als Zulassungsinhaber
Neben dem Sicherheitsaspekt wolle der Entwurf auch Innovationen fördern, so Xinhua. Und zwar mithilfe eines „Marktzulassungsinhaber-Systems“ (MAH). Das MAH-System werde seit 2015 in einem dreijährigen Pilotprojekt getestet: Darin dürfen nicht nur Pharmaunternehmen Marktzulassungen erwerben, sondern auch Forscher und Institutionen. Der Entwurf will das MAH-System aber strenger regeln – beispielsweise dadurch, dass Zulassungsinhaber verpflichtet sind, die Sicherheit und Wirksamkeit von Arzneimitteln auch nach dem Markteintritt weiter zu bewerten.
Außerdem ist eine Änderung des generellen Strafprozessrechts vorgesehen, auch das geht aus einer Meldung von Xinhua hervor. Ein Entwurf sehe vor, ein Strafverfahren auch dann fortsetzen zu können, wenn der Angeklagte aus China geflohen ist – etwa bei korruptionsbezogenen Kriminalfällen oder schweren Fällen, die die Staatssicherheit gefährden.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.