

Stuttgart - 06.11.2019, 17:50 Uhr
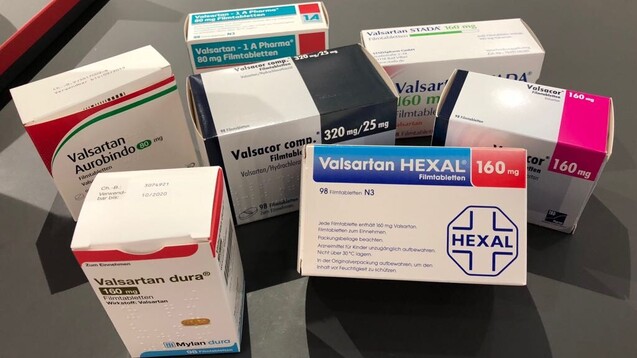
Welche Firmen können wieder Valsartan liefern? (c / Foto: privat)
Wer derzeit in der Lieferengpass-Liste des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) nach dem Wirkstoff Valsartan sucht, der stößt immer noch auf 86 Meldungen – darunter auch die beiden Anbieter Hexal und 1 A Pharma. Diese beiden teilten vergangenen Dienstag allerdings mit: „Ab sofort stehen Valsartan Hexal und Valsartan Hexal comp sowie Valsartan - 1 A Pharma und Valsartan - 1 A Pharma plus wieder zur Verfügung.“
Eines haben fast alle der 86 Mitteilungen zu offenen Valsartan-Lieferengpässen in der Liste des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) gemeinsam: Den Beginn des Engpasses, nämlich im Juli 2018 – also im Sommer als der Valsartan-Skandal seinen Lauf nahm. Wann jeweils das Ende der Engpässe erwartet wird, unterscheidet sich aber je nach Anbieter. Manche sollen erst im Juni, März oder Januar 2020 wieder lieferfähig sein, andere schon im November 2019. Auch für Valsartan von Hexal und 1 A findet sich dort noch das prognostizierte Ende des Engpasses datiert auf Dezember 2019.

Am gestrigen Dienstag hieß es aber nun in einer Pressemitteilung der beiden Anbieter (beide gehören zu Sandoz, einer Division der Novartis-Gruppe): „Sandoz hat neue Prozesse etabliert und setzt jetzt auf einen neuen Wirkstoffhersteller, der über ein alternatives Herstellungsverfahren verfügt.“ Somit seien Valsartan Hexal® und Valsartan Hexal® comp sowie Valsartan - 1 A Pharma® und Valsartan - 1 A Pharma® plus wieder in allen Wirkstärken und Packungsgrößen verfügbar.
Die Überprüfung jeder Charge erfolge mit Qualitätsstandards über behördliche Vorgaben hinaus, es sei nämlich „sichergestellt, dass die Werte bereits jetzt signifikant unter den aktuell von der Europäischen Arzneimittelagentur festgelegten Grenzwerten liegen“.
Schon mit Bescheid vom 11. April 2019 hatte das BfArM das europäische Risikobewertungsverfahren nach Artikel 31 der Richtlinie 2001/83/EG zu „Angiotensin-II-Rezeptor-Antagonisten (Sartane), die eine Tetrazol-Gruppe enthalten“ abgeschlossen. Das Gutachten des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur EMA zum Fall Valsartan wurde damit rechtsverbindlich. Seitdem müssen Unternehmen, die Sartane produzieren, ihren Herstellungsprozess so auslegen, dass keine Nitrosamin-Verunreinigungen mehr entstehen. Dazu wurde den Unternehmen allerdings eine Übergangsphase von zwei Jahren gewährt. Für diese Übergangszeit gelten die von der EMA (auf Basis internationaler Leitlinien) festgelegten Grenzwerte für NDMA (N-Nitrosodimethylamin) und NDEA (N-Nitrosodiethylamin). Produkte, in denen höhere Werte als diese Grenzwerte gemessen werden oder in denen sowohl NDMA als auch NDEA enthalten sind (egal in welcher Konzentration), sind in der EU nicht erlaubt.


Die im EU-Verfahren festgelegten Grenzwerte haben außerdem auch Eingang in die neueste Version des Europäischen Arzneibuchs Ph. Eur. 10.0 gefunden, das am 1. Januar 2020 in Kraft treten wird. Besagte Übergangszeit endet allerdings erst am 31. Dezember 2020. Ab dem 1. Januar 2021 ist somit wohl damit zu rechnen, dass die Unternehmen aufgefordert werden, nachzuweisen, dass ihre Produkte keine quantifizierbaren Mengen an NDEA oder NDMA (< 0,03 ppm) mehr aufweisen. Zu diesem Zeitpunkt soll dann das Ph. Eur. Supplement 10.3 in Kraft treten.
0 Kommentare
Das Kommentieren ist aktuell nicht möglich.