
- DAZ.online
- News
- Pasireotid bei M. Cushing
EU-Zulassung
Pasireotid bei M. Cushing
Der Schweizer Pharmakonzern Novartis hat Ende April 2012 die EU-weite Zulassung für Pasireotid (Signifor®) erhalten. Das Somatostatin-Analogon ist der erste Wirkstoff, der in der EU zur Behandlung des seltenen, aber lebensbedrohlichen Morbus Cushing zugelassen wurde.
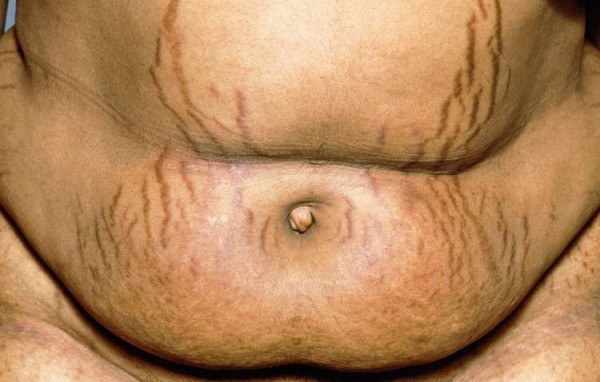
Beim Morbus Cushing produziert ein Tumor in den ACTH-produzierenden Zellen der Hypophyse zu viel ACTH, wodurch es zu einer vermehrten Stimulation der Nebennierenrinde und als Folge davon zu einer übermäßigen Cortisolproduktion kommt. Die Krankheitserscheinungen werden als Cushing-Syndrom bezeichnet. Symptome sind unter anderem Vollmondgesicht, Stammfettsucht, Stiernacken, Osteoporose, Hautatrophien, schwere Müdigkeit, Muskelschwäche und -schwund, Bluthochdruck oder Depressionen. Betroffen sind meist Erwachsene im Alter zwischen 20 und 50 Jahren und dreimal mehr Frauen als Männer.
Pasireotid ist eine Weiterentwicklung des Somatostatin-Analogons Octreotid, das die Hormonproduktion der Tumoren hemmt, etwa von Serotonin, und teilweise auch ihr Wachstum. Dabei bindet es an zwei der körpereigenen Somatostatin-Rezeptoren. Pasireotid könnte noch stärker wirksam sein, weil es an vier von fünf Rezeptor-Subtypen andockt.
Pasireotid kann eingesetzt werden bei Erwachsenen, die sich keiner chirurgischen Behandlung unterziehen konnten oder bei denen ein chirurgischer Eingriff nicht erfolgreich gewesen ist.






















14.05.2012, 11:23 Uhr