
- DAZ.online
- DAZ / AZ
- DAZ 40/2016
- Stabil – nur wie
Schwerpunkt Hilfsstoffe
Stabil – nur wie?
Stabilisatoren in dispersen Systemen
Während industriell hergestellte Arzneimittel vor der Zulassung diverse Stabilitätstests durchlaufen müssen, beruhen Überlegungen zur Stabilität und Haltbarkeit bei rezepturmäßig hergestellten Arzneimitteln häufig auf der vorhandenen Literatur. Nur bei standardisierten Rezepturen werden im Zuge der Entwicklung der Herstellungsvorschrift analytische Daten ermittelt, die eine Aussage zur Stabilität während der gesamten Laufzeit zulassen. Dennoch fordert der Gesetzgeber in § 14 der Apothekenbetriebsordnung (ApBetrO) auch für Rezepturarzneimittel eine „Verwendbarkeitsfrist mit dem Hinweis „verwendbar bis“ unter Angabe von Tag, Monat und Jahr und, soweit erforderlich, Angabe der Haltbarkeit nach dem Öffnen des Behältnisses oder nach Herstellung der gebrauchsfertigen Zubereitung“ [1]. DAC/NRF [2] bieten dazu neben konkreten Angaben für die standardisierten Rezepturen oder im Rezepturenfinder in den allgemeinen Hinweisen Anhaltspunkte zur Haltbarkeit der unterschiedlichen Darreichungsformen. Dazu müssen die im Rahmen der nach dem Europäischen Arzneibuch geforderten angemessenen Risikobeurteilung Parameter wie „Qualität der Wirkstoffe, Hilfsstoffe und Behältnisse, Ausgestaltung des Herstellungsprozesses, Umfang und Aussagekraft von Kontrollen, die Stabilität der Zubereitung“ bewertet und gegebenenfalls durch entsprechende Maßnahmen verbessert werden (siehe Kasten „Stabilitätsbeeinflussende Effekte“).
Stabilitätsbeeinflussende Effekte nach [4]
- chemische Veränderungen
Hydrolyse, Oxidation, Reduktion, Umlagerung, Decarboxylierung, Polymerisation
- physikalische Veränderungen
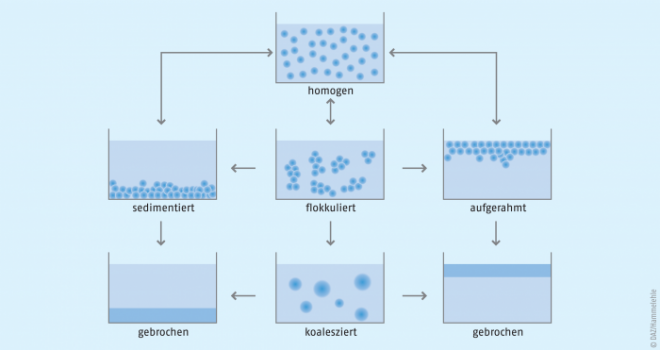
Brechen, Sedimentation, Aufrahmung, Flockung, Koaleszenz, Kuchenbildung, Konzentrationsänderungen
- mikrobielle Veränderungen
Trübung, Geruch, Gärung, Schimmelbildung
Zwei Darreichungsformen – ein Problem
Suspensionen sind disperse Systeme vom Typ fest–flüssig, Emulsionen vom Typ flüssig–flüssig. Beide Darreichungsformen werden in der oralen oder topischen Therapie angewendet und können nach dem Europäischen Arzneibuch unter anderem Stabilisatoren enthalten. Die physikalische Stabilität dieser Systeme lässt sich vereinfacht anhand von zwei Gesetzmäßigkeiten verdeutlichen:
Die Stoke´sche Gleichung [3] beschreibt den Zusammenhang zwischen der Teilchengröße der dispersen inneren Phase, der Viskosität der äußeren Phase und der resultierenden Sedimentationsgeschwindigkeit.
v = Sedimentationsgeschwindigkeit der inneren Phase
r = Radius der Partikel der dispergierten Phase
ρ1 = Dichte der äußeren Phase
ρ2 = Dichte der dispergierten inneren Phase
g = Erdbeschleunigung
η = Viskosität der Dispersionsflüssigkeit
Demnach kann man durch Zugabe von Hilfsstoffen, welche die Dichte und Viskosität der äußeren Phase beeinflussen, das Absinken bzw. Aufsteigen/Aufrahmen der dispersen Phase verhindern. Nicht berücksichtigt wird hierbei der Einfluss durch die Ladung der dispergierten Phase.
Dieser wird durch die Theorie von Derjaguin, Landau, Verwey und Overbeek beschrieben (DLVO-Theorie), die eine Anziehung durch Van-der-Waals-Kräfte und die elektrostatische Abstoßung der Partikel berücksichtigt [4]. Beide Theorien haben zwar Schwächen, da sie einerseits von der freien Bewegung der inneren Phase ohne Beeinflussung der Teilchen untereinander sowie andererseits von gleichmäßig großen Teilchen ausgehen, dennoch werden sie üblicherweise bei der Beurteilung der Stabilität eines dispersen Systems angewendet [4]. Problematisch für die Formulierung einer über die Laufzeit hinweg stabilen Suspension sind Vorgänge wie Flotation, Sedimentation und Flockung. Aus beiden Letzteren kann die Bildung eines zementartigen Kuchens resultieren, der sich irreversibel am Boden des Gefäßes ausbildet. Bei Emulsionen können Veränderungen wie Sedimentation, Aufrahmung, Flockung und Koaleszenz letztendlich zum Zusammenfließen der inneren Phase der Emulsion, der Phasentrennung führen (siehe Abb. 1).
Eine Möglichkeit nach der Gesetzmäßigkeit der Stoke´schen Gleichung wäre nun die Verringerung der Teilchengröße der dispergierten Phase. Bei Suspensionen wäre demnach der Einsatz von mikronisierten Wirkstoffen vorteilhaft, allerdings neigen kleinere Teilchen zur Agglomeration, was für die Stabilität nachteilig wäre. Bei Emulsionen würde die Verkleinerung der Tropfen der inneren Phase zu einer Erhöhung der Grenzflächenenergie führen, was einerseits einen erhöhten Energieaufwand bei der Herstellung bedeutet und andererseits dem natürlichen Bestreben dieses Systems widerspricht, sich dem niedrigsten energetischen Zustand zu nähern.
Die zweite Möglichkeit zur Stabilisierung disperser Systeme ist der Einsatz von anorganischen Feststoffen oder organischen makromolekularen Verbindungen zur Erhöhung der Viskosität der äußeren Phase, zur Ausbildung von Grenzflächenfilmen oder zur Abschirmung der Partikel der inneren Phase untereinander. Dazu gehören z. B. makromolekulare Schleimstoffe wie Tragant und Carrageen, Methylcellulose, Hydroxyethylcellulose oder Hypromellose.
Suspensionen
Besondere Bedeutung hat diese Arzneiform bei der Versorgung von pädiatrischen Patienten. Löst sich der Wirkstoff nicht in einer wässrigen äußeren Phase, so bleibt oftmals nur die Herstellung einer Suspension, um problematische Hilfsstoffe wie Ethanol zur Lösungsvermittlung nicht einzusetzen. Neben der Vermeidung derartiger Hilfsstoffe hat die Verarbeitung als Suspension zudem den Vorteil, dass der Wirkstoff geschmacklich nicht so wahrgenommen wird, als wenn er gelöst vorliegen würde.
Grundsätzlich sollte bei Suspensionen die Viskosität der äußeren Phase nur so weit erhöht werden, dass die Fließfähigkeit des Systems und in Folge die Dosiergenauigkeit des Arzneimittels gewährleistet werden können. Aufgrund der chemischen Struktur sind viele dieser makromolekularen Verbindungen empfindlich gegenüber Elektrolyten, was bei der Plausibilitätsprüfung und Risikobeurteilung von Rezepturen zu beachten ist.
Paradoxerweise können gerade Suspensionsstabilisatoren, die auf Schleimstoffen basieren, auch zur Ausbildung von festen Sedimenten führen. Beispielhaft sei hier arabisches Gummi genannt, das häufig zur unerwünschten festen Kuchenbildung führt – eine Instabilität, die es auf jeden Fall zu vermeiden gilt [4, 5]. Durch Erhöhung der gegenseitigen Abstoßung der dispergierten Teilchen können grenzflächenaktive makromolekulare Verbindungen einer derartigen Kuchenbildung entgegenwirken. Die Wahl des Suspensionsstabilisators ist somit abhängig von seiner chemischen Struktur, der sonstigen Bestandteile der Suspension sowie Eigenschaften und Konzentration des Wirkstoffs. Eine Übersicht dazu bieten die „Tabellen für die Rezeptur – Hydrogelbildner“ vom NRF/DAC sowie der Beitrag „Nicht nur einfach angedickt“ in der DAZ 2016, Nr. 13, S. 36.
Ein Beispiel für die Verwendung von mehreren Suspensionsstabilisatoren in einer Suspensionsgrundlage ist „Vehicle for Oral Suspension“ USP/NF: Neben einem anorganischen Sedimentationsverzögerer sind die organischen anionischen Polysaccharide, Xanthangummi und Carrageenan sowie der anionische Celluloseether, Carmellose-Natrium und mikrokristalline Cellulose zur Suspensionsstabilisierung enthalten (siehe Kasten).
Vehicle for Oral Suspension USP/NF [7]
Mikrokristalline Cellulose 0,800 g
Xanthangummi 0,200 g
Carrageenan 0,150 g
Carmellose-Natrium 0,025 g
Citronensäure Monohydrat 0,275 g
Natriummonohydrogenphosphat
wasserfrei 0,120 g
Simethicon 0,100 ml
Kaliumsorbat 0,100 g
Methyl-4-hydroxybenzoat 0,100 g
gereinigtes Wasser ad 100,0 ml
Mikrokristalline Cellulose
Zwar ist mikrokristalline Cellulose vor allem als typisches Trockenbindungsmittel aus der Tablettierung bekannt, jedoch quellen einige Typen dieses Rohstoffes aufgrund ihrer Partikelgröße, so dass sie zur Suspensionsstabilisierung durchaus geeignet sind [6]. In der Praxis wird das „Vehicle for Oral Suspension“ in einem bestimmten Verhältnis mit dem „Vehicle for Oral Solution“ (siehe Kasten) verdünnt und dient als Grundlage zur Herstellung von Suspensionen [7].
Vehicle for Oral Solution USP/NF [7]
Xanthangummi 0,05 g
Glycerin 85% 10,00 ml
Sorbitol-Lösung 25,00 ml
Saccharin-Natrium 0,10 g
Citronensäure Monohydrat 1,50 g
Natriumcitrat 2,00 g
Kaliumsorbat 0,10 g
Methyl-4-hydroxybenzoat 0,10 g
gereinigtes Wasser ad 100,0 ml
Tragant
Eine Stabilisierung allein auf Basis von Tragant nutzen dagegen die Naproxen-Suspension NRF 2.5. und Hydrochlorothiazid-Suspension NRF 26.4. [2]. Hier führt der Einsatz von Tragant hauptsächlich durch Erhöhung der Viskosität der äußeren Phase zur Stabilisierung der Suspensionen und verdeckt durch seinen leicht schleimartigen Charakter gerade bei bitteren Wirkstoffen deren unangenehmen Geschmack. In beiden Zubereitungen wird dieses Polysaccharid in einer Konzentration von 0,6% hinzugefügt. Im Gegensatz dazu beträgt die Konzentration zur O/W-Emulsionsstabilisierung häufig 2%.
Weitaus komplexer erscheint die „Nitrofurantoin Oral Suspension“ aus dem Formularium der Nederlandse (FNA) (siehe Kasten), da der Wirkstoff hier zunächst mit Siliciumdioxid hydrophilisiert wird, bevor er in der äußeren Phase dispergiert wird [8].
Nitrofurantoin Oral Suspension nach FNA [8]
Nitrofurantoin 1,000 g
Aluminium-Magnesium-Silicat 0,900 g
Carmellose-Natrium 0,900 g
Citronensäure Monohydrat 0,067 g
Methyl-4-hydroxybenzoat 0,067 g
Siliciumdioxid hochdispers 0,250 g
Zuckersirup 33,600 g
gereinigtes Wasser 70,300 g
Emulsionen
Klassische Emulgatoren, die in dieser DAZ auf Seite 94 vorgestellt werden, verringern vor allem durch den Aufbau energetischer Barrieren das Zusammenfließen der Phasen. Neben dem Einsatz von einzelnen Emulgatoren und Tensiden zur Herabsetzung der Grenzflächenspannung können in der Rezeptur vor allem O/W-Emulsionen ähnlich wie Suspensionen auch durch den Einsatz von makromolekularen Verbindungen oder kolloidalen Feststoffen stabilisiert werden. Erstere werden in ihrer Eigenschaft zur mechanischen Stabilisierung auch als Pseudo- oder Quasiemulgatoren bezeichnet [4]. Zu den Quasiemulgatoren gehören unter anderem Tragant, Celluloseether, Carbomere oder auch Carrageen, das häufig zur Stabilisierung von Kosmetika oder Lebensmitteln eingesetzt wird. Die Eigenschaften dieses Rohstoffes werden durch die Hauptcopolymere κ-, λ- und ι-Carrageen bestimmt. Als anionisches Polysaccharid trägt es neben der Erhöhung der Viskosität der äußeren Phase auch zur elektrostatischen Abstoßung der dispergierten Teilchen bei [3, 4]. Aufgrund der Tatsache, dass einige Celluloseether allerdings wie Emulgatoren eine gewisse Grenzflächenaktivität aufweisen, ist die Bezeichnung Quasiemulgator nicht immer ganz zutreffend [4].
Der Vorteil von Emulsionen, die nicht mit den klassischen Emulgatoren oder Tensiden hergestellt worden sind, äußert sich nicht nur in der eventuell höheren Stabilität, sondern auch in der besseren Verträglichkeit, da sie kein Allergisierungspotenzial besitzen. Insbesondere für Zubereitungen zur kutanen Anwendung oder Kosmetika wie Sonnenschutzgele für Patienten mit polymorpher Lichtdermatose stellen diese Stabilisatoren eine interessante Alternative dar. Derartige Zubereitungen sind häufig Emulsionen vom O/W-Typ mit einem Lipidanteil zwischen 2 und 20% [4]. Ebenfalls zur Herstellung von emulgatorfreien Emulsionen zum Sonnenschutz können Zinkoxid oder Titandioxid verwendet werden, die auch gleichzeitig den Lichtschutzfilter darstellen. Hier beruht die Stabilisierung darauf, dass der direkte Kontakt der Emulsionstropfen durch den Feststoff verhindert wird [4].
Nach ihrem Erfinder Spencer Umfreville Pickering werden allein mit kolloidalen Feststoffen wie Bentonit, Siliciumdioxid, Zinkoxid oder Titandioxid hergestellte derartige disperse Systeme auch Pickering-Emulsionen bezeichnet. Welcher Emulsionstyp dabei ausgebildet wird, hängt von der Benetzbarkeit des Feststoffes durch die flüssige Phase, dem resultierenden Kontaktwinkel und von der Beeinflussung des Kontaktwinkels durch andere Hilfsstoffe ab. Durch die Kombination einer makromolekularen grenzflächenaktiven Verbindung und einem kolloidalen Feststoff in einer Emulsion können in Abhängigkeit von den Eigenschaften der eingesetzten Stoffe z. B. der Kontaktwinkel zwischen flüssiger Phase und Feststoff und die Tropfengröße der inneren Phase beeinflusst werden [9].
Trotz der interessanten Möglichkeiten sind Rezepturbeispiele von O/W-Emulsionen ohne klassische Emulgatoren leider nur selten zu finden. Beispielhaft zu nennen sind ein hypromellosestabilisiertes Hydrodispersionsgel nach [10, 11] (Kasten Hydrodispersionsgel) und die daraus optimierte Zubereitung nach dem Beitrag „Rezeptur – offen für ausgefallene Grundlagen“ in der DAZ 2011, Nr. 19, S. 62 [10] sowie eine Hypromellose-stabilisierte Emulsionen mit Cardiospermum halicacabum nach Wollenweber et al. [12].
Hydrodispersionsgel [11]
mittelkettige Triglyceride 15,0 g
Weizenkeimöl 5,0 g
Hypromellose 2000 2,0 g
gereinigtes Wasser 78,0 g
Dagegen sind Mischsysteme wie in der Carbomer-haltigen hydrophilen Lauromacrogol-400-Emulsion 5% häufiger anzutreffen. Hier wird die Emulsion durch Carbomer 50.000 in der äußeren Phase stabilisiert. So wird durch Lauromacrogol 400 die zu erwartende Aufrahmung verhindert [13] (siehe Kasten).
Carbomer-haltige hydrophile Lauromacrogol-400-Emulsion 5% [13]
Lauromacrogol 400 5,00 g
Propylenglycol 20,00 g
Carbomer 50.000 0,25 g bis 0,5 g
Trometamol 0,20 g
Basiscreme DAC 10,00 g
gereinigtes Wasser ad 100,00 g
Auf ähnlichem Wege, nämlich durch Einsatz von Hydroxyethylcellulose, können auch hydrophile Cremes, die Dimethylsulfoxid enthalten sollen, stabilisiert werden. Derartige Rezepturvorschriften z. B. in Kombination mit Diclofenac-Natrium werden unter anderem als Therapieoption beim komplexen regionalen Schmerzsyndrom (CRPS) eingesetzt [14].
Vielfältiger Einsatz in der Rezeptur
Die Verwendung von makromolekularen Verbindungen und kolloidalen Feststoffen in der Rezeptur bedarf sicher einiger Erfahrung. Ihre Verwendung bietet jedoch interessante Möglichkeiten zur Realisierung von Therapieoptionen zur Versorgung spezieller Patientengruppen. |
Literatur
[1] Cyran W, Rotta C. Apothekenbetriebsordnung-Kommentar. 5. Auflage. Deutscher Apotheker Verlag, Stuttgart 2012
[2] DAC/NRF-Kommission, ABDA – Bundesvereinigung Deutscher Apothekerverbände. Deutscher Arzneimittel-Codex®/Neues Rezeptur-Formularium® (DAC/NRF). Loseblattwerk in sechs Ordnern, Eschborn: Pharmazeutischer Verlag GmbH 2016
[3] Schmidt PC. Pharmazeutische Hilfsstoffe. Eschborn, Pharmazeutischer Verlag GmbH 2013
[4] Fahr A. Voigt. Pharmazeutische Technologie. 12. Auflage, Deutscher Apotheker Verlag, Stuttgart 2015
[5] Europäisches Arzneibuch 8.0–8.2. Amtliche deutsche Ausgabe, Wissenschaftliche Verlagsgesellschaft, Stuttgart 2015
[6] Bauer K, Frömming K, Führer C. Pharmazeutische Technologie. 8. Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart 2006
[7] Vehicle for Oral Suspension. www.pharmacopeia.cn/v29240/usp29nf24s0_m384.html und Vehicle for Oral Suspension, sugar free. www.pharmacopeia.cn/v29240/usp29nf24s0_m383.html, US. Pharmacopeia 29
[8] Marriott J, Wilson K, Langley C, Belcher D. Pharmaceutical Dispensing and Compounding. Pharmaceutical Press 2010
[9] Kannen B. Herstellung und Charakterisierung fester Darreichungsformen unter Verwendung von Pickering-Emulsionen als Drug Delivery Systeme. Dissertation. Tübingen: Fakultät für Chemie und Pharmazie der Eberhard Karls Universität Tübingen 2010
[10] Wolff G. Rezeptur – offen für ausgefallene Grundlagen. DAZ 2011;19:62
[11] Daniels R. Neuartige Gelsysteme. DermoTopics – Organ der GD — Gesellschaft für Dermopharmazie e.V. 2002;2, www.dermotopics.de/german/ausgabe_2_02_d/daniels_gelsysteme_2_02_d.htm
[12] Wollenweber C, Oschmann R, Daniels R. Hypromellose-stabilisierte Emulsionen als Träger für homöopathische Urtinkturen. Pharm Ind 2002;1:64, Aulendorf: Editio Cantor Verlag
[13] Rezepturhinweis – Polidocanol zur Anwendung auf der Haut. DAC/NRF-Kommission, ABDA – Bundesvereinigung Deutscher Apothekerverbände. Deutscher Arzneimittel-Codex®/Neues Rezeptur-Formularium® (DAC/NRF), http://dacnrf.pharmazeutische-zeitung.de
[14] Rezepturhinweis – Diclofenac-Natrium. DAC/NRF-Kommission, ABDA – Bundesvereinigung Deutscher Apothekerverbände. Deutscher Arzneimittel-Codex®/Neues Rezeptur-Formularium® (DAC/NRF), http://dacnrf.pharmazeutische-zeitung.de
Weitere Beiträge zum Schwerpunkt Hilfsstoffe in der Rezeptur
- Stefan Seyferth: In Lösung bringen. Ohne Lösungsmittel geht nichts in der Rezeptur
- Andreas Ziegler: Immer gut Puffern. Spagat zwischen Stabilität und Verträglichkeit
- Buchtipps:
– Strukturiert vorgehen
– Machen Sie Ihre Mitarbeiter fit
– Einmal gedreht und alles parat - Heiko Schiffter-Weinle: Schutz vor Verderben. Konservierungsmittel in der Rezeptur
- Heiko Schiffter-Weinle: Damit nichts bricht. Emulgatoren helfen bei galenischen Inkompatibilitäten
- Jutta Wittmann: Nicht nur für Zäpfchen. Hartfett ist eine variable Grundmasse

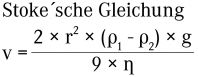






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.