
- DAZ.online
- DAZ / AZ
- DAZ 35/2010
- DGOP begrüßt ...
DAZ aktuell
DGOP begrüßt Fortentwicklung der ApoBetrO
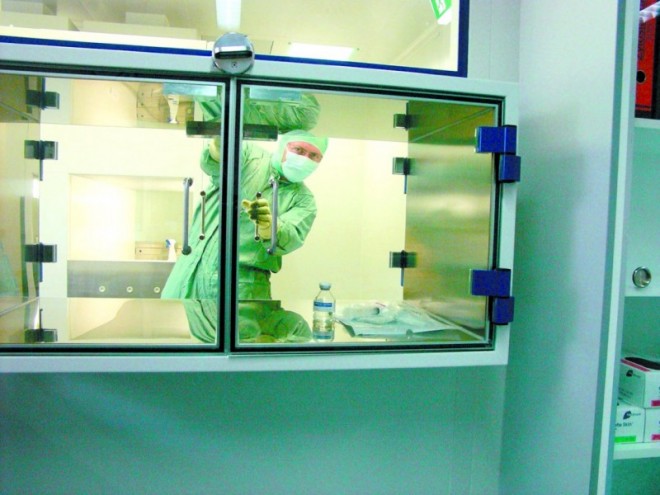
Dokumentierte Verfahren zur Vermeidung von partikulärer und mikrobieller Kontamination und zur Validierung der aseptischen Arbeitstechnik sind sowohl immanenter Bestandteil der etablierten Organisations- und Qualitätssicherungssysteme als auch Gegenstand der bereits seit 2000 von der Deutschen Gesellschaft für Onkologische Pharmazie (DGOP) etablierten Zertifizierung für Zytostatika-herstellende Bereiche in öffentlichen und Krankenhaus-Apotheken. Die DGOP begrüßt deshalb gerade in diesem Zusammenhang die Fortentwicklung der Apothekenbetriebsordnung (ApoBetrO) mit der Etablierung eines verbindlichen QM-Systems in deutschen Apotheken, auch als eine folgerichtige und konsequente berufspolitische Umsetzung des § 135a SGB V.
Die Herstellung applikationsfertiger Zytostatika-Lösungen für Krebskranke erfolgt in den Apotheken als patientenindividuelle Arzneimittelversorgung vor Ort. Deren spezifische Räumlichkeiten, Schutzausrüstungen, Verantwortlichkeiten, Prüf- und Dokumentationspflichten werden sowohl in der Leitlinie der Bundesapothekerkammer (BAK) "Aseptische Herstellung und Prüfung applikationsfertiger Parenteralia mit toxischem Potenzial" als auch in den Qualitätsstandards für den pharmazeutisch-onkologischen Service als verbindliche und praktikable Mindeststandards definiert. Allein aus dem strukturellen Unterschied der patientennahen Rezeptur-herstellenden Apotheke zu einem industriellen Herstellungsbetrieb gemäß §13 AMG resultieren unterschiedliche Anforderungen an die Arzneimittelsicherheit im Rahmen der Herstellung und Prüfung der Arzneimittel. Die Übertragung der Anforderungen der EG-GMP-Leitlinien oder einzelne Regelungen daraus, die der europäische Gesetzgeber an die pharmazeutische Industrie stellt, auf die nach höchsten Sicherheitsstandards arbeitenden Apotheker in der öffentlichen und Krankenhausapotheke wäre aus Sicht der DGOP sachlich nicht gerechtfertigt. Zudem ist die DGOP der Ansicht, dass eine solche Übertragung der Anforderungen der EG-GMP-Leitlinien auf die Apotheken Deutschlands einen kostenintensiven Mehraufwand darstellt, der kein Mehr an Sicherheit für die Zubereitung von Rezepturen bedeutet und den viele kleine und mittlere Apotheken nicht tragen könnten. Eine unreflektierte Übernahme der EG-GMP-Leitlinien in die ApBetrO würde somit anstelle einer gewünschten Qualitätssicherung des erbrachten hohen Leistungsniveaus zu einer deutlichen Verschlechterung der pharmazeutischen Betreuung vor Ort führen.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.