
- DAZ.online
- DAZ / AZ
- DAZ 1/2005
- 2004 kamen 33 neue ...
DAZ aktuell
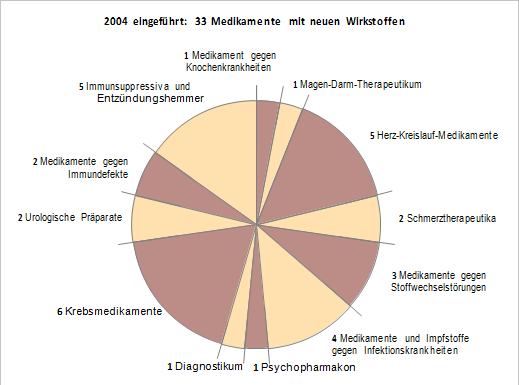
2004 kamen 33 neue Wirkstoffe auf den Markt
Unter den im vergangenen Jahr neu eingeführten Arzneimitteln sind sechs Präparate zur Behandlung verschiedener Krebserkrankungen, fünf Präparate gegen Herz-Kreislauferkrankungen, fünf Immunsuppressiva und Entzündungshemmer sowie zwei Medikamente gegen Immundefekte. HIV-Infizierten kommen zwei Präparate mit neuen Wirkstoffen zugute, die – in Kombination mit anderen – die Virenvermehrung aufhalten.
Weitere Medikamente sind für Patienten mit Stoffwechselstörungen, Schizophrenie, chronischen Schmerzen, Haut-, Knochen- und Durchfallerkrankungen und Harninkontinenz eingeführt worden. Schließlich gehören auch ein Schluckimpfstoff, der Cholera vorbeugt, und ein Kontrastmittel für die Kernspintomographie zu den Neueinführungen 2004.
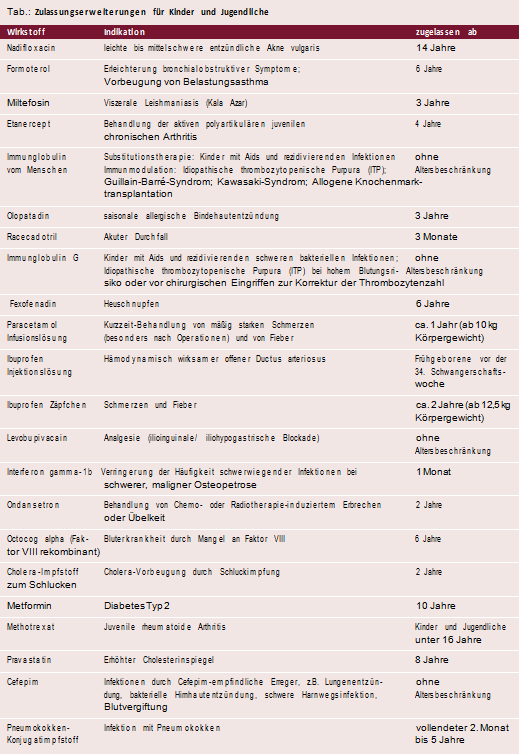
22 Arzneimittel nun auch für Kinder zugelassen
Zulassungserweiterungen kamen 2004 vor allem Kindern und Jugendlichen zugute: Für sie hat sich das therapeutische Repertoire um 22 Medikamente erweitert (s. Tabelle). So stehen an Typ-2-Diabetes erkrankten Kindern ab zehn Jahren nun Metformin-Tabletten zur Verfügung. Für Kinder ab acht Jahren mit erblich bedingt erhöhtem Cholesterinspiegel wurde mit Pravastatin ein Statinpräparat verfügbar.
Für die Altersgruppe ab zwei Jahren stehen zusätzliche Arzneimittel zur Behandlung von Schmerzen und Fieber, Erbrechen und Übelkeit bei der Krebstherapie sowie ein Cholera-Impfstoff zum Schlucken zur Verfügung. Weitere Zulassungen ohne Altersbeschränkung wurden für Tabletten und Fertigspritzen zur Behandlung von rheumatischen Erkrankungen sowie für Injektions- und Infusionslösungen zur Therapie bakterieller Lungen- oder Hirnhautentzündung, schweren Harnwegsinfektionen und Blutvergiftung erteilt.
Erfolge der europäischen Orphan-Drug-Verordnung
Auch einige neue Orphan Drugs wurden eingeführt: So etwa für eine seltene Störung des Blutkreislaufs bei Frühgeborenen und eine seltene angeborene Stoffwechselstörung bei Kindern. Yzer betonte, dass die Einführung der europäischen Orphan-Drug-Verordnung im Jahr 2000 sehr sinnvoll war. Diese Regelung unterstützt Unternehmen bei der Entwicklung von Medikamenten gegen seltene Krankheiten unter anderem durch eine Marktexklusivität für das Medikament nach der Zulassung. "In ähnlicher Weise könnte auch die Entwicklung von mehr Medikamenten für Kinder gefördert werden", erläuterte Yzer. Der VFA begrüße daher, dass in Europa ein Gesetzgebungsverfahren zu Arzneimitteln für Kinder auf den Weg gebracht wurde.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.