
- DAZ.online
- DAZ / AZ
- DAZ 38/2021
- Das Statin-Roulette
Arzneimittel und Therapie
Das Statin-Roulette
Wie man herausfindet, wer Lipidsenker wirklich nicht verträgt
Wirksamkeit und Sicherheit von Statinen, genauer 3-Hydroxy-3-Methylglutaryl-Coenzym-A(HMG-CoA)-Reduktasehemmern sind unbestritten. Dass sie dennoch bei den Patienten auf Ablehnung stoßen, ist vor allem Muskelsymptomen geschuldet, für die sie verantwortlich gemacht werden (Statin-assoziierte Muskelsymptome, SAMS). Die große Mehrheit der Betroffenen kann trotzdem mit Statinen weiterbehandelt werden – ein erklärtes Ziel, denn eine reduzierte Therapietreue geht in diesem Fall linear mit einer erhöhten Sterblichkeit einher.
Wann spricht man von Unverträglichkeit?
Eine einheitliche Definition von Statin-Intoleranz gibt es nicht. Fakt ist: Das Auftreten von Symptomen oder Laboranomalien allein reicht nicht, um von Unverträglichkeit zu sprechen. Sie müssen im zeitlichen Zusammenhang mit der Therapie auftreten, sich nach Absetzen des Statins bessern und bei Reexposition bzw. dem Wechsel auf ein anderes Statin wieder auftreten. Am häufigsten wird von Myalgien berichtet, die allerdings auch zahlreiche andere Ursachen haben können. Typischerweise treten Statin-assoziierte Muskelsymptome vier bis sechs Wochen nach Therapiebeginn, nach einer Dosiserhöhung oder nach dem Verschreiben eines interagierenden Medikaments auf. Die Schmerzen sind meist symmetrisch und betreffen große Muskelgruppen wie Schulter- und Beckengürtel, Arme und Beine. Daneben sind auch Krämpfe, Muskelschwäche und Schweregefühl bei Bewegung möglich. Die European Atherosclerosis Society (EAS) gibt sich im internationalen Vergleich recht klinisch bei der Diagnose und zieht die Höhe der Kreatinkinase-Aktivität als Biomarker heran, die allerdings weder sensitiv noch spezifisch für Statin-assoziierte Muskelsymptome ist. Doch es stehen weder besser geeignete Laborparameter noch bildgebende Verfahren für die Diagnose zur Verfügung. In der Praxis wird häufig der Kriterienkatalog von Rosenson et al. (s. Abb.1) herangezogen, nicht zuletzt um einen Nocebo-Effekt auszuschließen.
Abb. 1: Punkteschema für die Diagnostik von Statin-assoziierten Muskelsymptomen, modifiziert nach Rosenson et al.
Alles nur Einbildung?
Auffallend ist, dass die Prävalenz von Myalgien im Zusammenhang mit einer Statin-Therapie in Beobachtungsstudien und in der Realität mit fast 30% beziffert wird, während sie sich in randomisierten, kontrollierten Studien auf einem Niveau von 1 bis 5% bewegt. Viele führen diese Diskrepanz auf einen ausgeprägten Nocebo-Effekt zurück.(s. auch DAZ 2021 Nr. 20, S. 38 „Nocebo-Effekt bremst Statine aus“) Tatsächlich zeigen mehrere Arbeiten, dass viele Patienten Nebenwirkungen durch die pure Tabletteneinnahme entwickeln und nicht durch den Wirkstoff an sich. So auch in der SAMSON-Studie, einer sogenannten „N=1-Studie“, in der jeder Patient seine eigene Kontrolle war und verblindet entweder mit Statin oder Placebo behandelt wurde. Doch ganz so einfach ist es nicht: Nicht selten werden Patienten mit Muskelschmerzen von vorneherein ausgeschlossen und immerhin gibt es molekulare Mechanismen, darunter Veränderungen des zellulären Energiestoffwechsels, und starke Assoziationen zu Polymorphismen (SLCO1B1-Gen), die Statin-assoziierte Muskelsymptome plausibel machen. Cerivastatin wurde Ende 2001 weltweit sogar vom Markt genommen, als vermehrt Rhabdomyolysen und damit verbundene Nierenschäden beobachtet wurden. Unter Statin-Therapie berichtete Beschwerden sollte man ernst nehmen. Bei einer geschätzten Prävalenz von fünf bis zehn Prozent in Deutschland muss jährlich mit 235.000 bis 470.000 Betroffenen gerechnet werden. Neun von zehn dieser Patienten können dauerhaft mit einem Statin behandelt werden. Dabei sind empathisches Vorgehen seitens der Behandler mit Unterstützung durch andere Gesundheitsberufe, darunter auch Apotheker, gefragt.
Ein wichtiger Faktor: Sport
Das Risiko für Statin-assoziierte Muskelsymptome steigt mit höheren Statin-Dosierungen exponentiell. Zu beachten sind Kontraindikationen sowie notwendige Dosisanpassungen bei Niereninsuffizienz (siehe Kasten: „Wie man Statin-assoziierte Muskelsymptome vermeiden kann“). Auch Interaktionen spielen eine wichtige Rolle, so kann die gleichzeitige Einnahme von CYP3A4-Inhibitoren wie Makrolidantibiotika, Verapamil oder Grapefruitsaft sowie CYP2C9-Inhibitoren wie Azolantimykotika, Fluoxetin oder Amiodaron den Statin-Spiegel erhöhen. Weitere Risikofaktoren sind weibliches Geschlecht, Alter, metabolisches Syndrom, Vitamin-D-Mangel, unkontrollierte Hypothyreose, Alkoholabusus und extreme körperliche Betätigung.
Wie man Statin-assoziierte Muskelsymptome vermeiden kann:
- Kontraindikationen und Interaktionen beachten!
- bei schweren körperlichen Belastungen (z. B. Marathonlauf) mit der Einnahme von Statinen vorübergehend pausieren
- Dosisanpassung bei Niereninsuffizienz
Die Kreatinkinase ist gerade in puncto Sport ein wenig verlässlicher Marker. In der Regel ist ihre Aktivität bei Statin-assoziierten Muskelsymptomen nicht erhöht. Bei Patienten mit tolerierbaren Muskelsymptomen und einer Kreatinkinase unter dem Zehnfachen der oberen Norm wird das Statin meist beibehalten, ggf. in reduzierter Dosierung. Bei sportlich aktiven Patienten können leichte Erhöhungen bis zu 400 U/l auch trainingsbedingt sein. Für einen Zusammenhang mit der Statin-Therapie spricht ein Abfallen der Kreatinkinase-Aktivität innerhalb weniger Wochen nach Absetzen und ein erneutes Ansteigen bei Reexposition. Werte, die das Zehnfache der oberen Grenze des Normalbereichs übersteigen, sollten alarmieren. Dahinter kann sich eine Rhabdomyolyse verbergen, die lebensbedrohlich ist, mit einer Inzidenz von 0,01% aber auch äußerst selten ist. Ebenso kann eine immunvermittelte nekrotisierende Myopathie vorliegen, deren Diagnose durch das Vorhandensein von Antikörpern gegen die HMG-CoA-Reduktase unterstützt wird und bei der die Beschwerden trotz Absetzen des Statins zunehmen können.
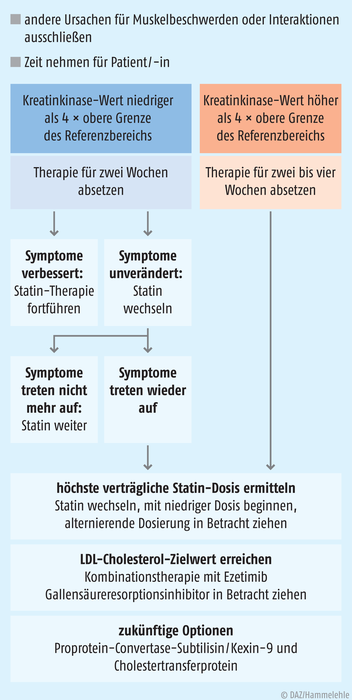
Dosistitration kostet Zeit
Treten unter Statin-Therapie muskuläre Beschwerden auf, muss zunächst geklärt werden, ob eine erhöhte körperliche Aktivität oder eine Interaktion dahinterstecken. In den meisten Fällen wird jedoch keine eindeutige Ursache gefunden werden können. So oder so sollte mit der Statin-Einnahme pausiert werden (s. Abb. 2). Bleiben die Symptome bestehen, spricht dies gegen das Vorliegen einer Nebenwirkung und es wird das gleiche Statin wieder angesetzt und auf die maximal verträgliche Dosis titriert. Bessern sich die Beschwerden durch die Pause, ist es allein schon aus psychologischer Sicht sinnvoll, den Wirkstoff zu wechseln. Wird auch das zweite Statin nicht vertragen, sollte ein drittes Statin in niedriger Dosierung versucht werden, ggf. unter Teilen von Tabletten, oder eine alternierende Tageseinnahme, beispielsweise Einnahme alle zwei Tage oder noch seltener. Erfolgsmesser ist das Erreichen des LDL-Cholesterol-Zielwerts, möglichst bei Beschwerdefreiheit (siehe Kasten: „Heiß diskutiert: Wie weit muss das LDL-Cholesterol gesenkt werden?“).
Heiß diskutiert: Wie weit muss das LDL-Cholesterol gesenkt werden?
Dass das LDL-Cholesterol bei Dyslipidämie gesenkt werden muss, um das Risiko für kardiovaskuläre Ereignisse zu senken, ist klar. Aber wie weit? Eine große prospektive Kohortenstudie aus Dänemark kam Anfang dieses Jahres zu dem Schluss, dass ein LDL-Spiegel von 140 mg/dl mit dem geringsten Mortalitätsrisiko assoziiert ist. Dieser Zielwert liegt weit über jenen, die bisher angestrebt wurden und die umso niedriger sind, je höher das kardiovaskuläre Risiko ist (bis zu < 55 mg/dl). In einem Schreiben zur neuen Therapieoption Bempedoinsäure weist die Barmer-Krankenkasse Ärztinnen und Ärzte ausdrücklich auf diesen „optimalen LDL-Spiegel“ hin. Die Lipid-Liga (DGFF) und die D.A.CH.-Gesellschaft Prävention sahen sich veranlasst, die Fakten in einer Stellungnahme wieder gerade zu rücken. Es handele sich um „eine irreführende Verkürzung und Fehlinterpretation der Studie“. Die Studienautoren selbst betonen, dass der Wert von 140 mg/dl nicht für eine lipidsenkende Therapie zur Vorbeugung von atherosklerotischen Herz-Kreislauf-Erkrankungen und der Sterblichkeit herangezogen werden darf. Es gelten nach wie vor die Empfehlungen der aktuellen ESC/EAS-Leitlinien zur Diagnostik und Therapie der Dyslipidämien, die auf prospektiven, randomisierten Endpunktstudien und genetischen Assoziationsstudien basieren. Dabei gibt es nicht den LDL-Cholesterol-Schwellenwert, weil das Risiko ein Kontinuum darstelle. Die Fachgesellschaften kritisieren den Versuch der Barmer, in die medizinische Behandlung einzugreifen.
Welches Statin zuerst?
Um herauszufinden, ob ein Patient wirklich unter einer Statin-Unverträglichkeit leidet, sollten drei möglichst unterschiedliche Vertreter der Substanzklasse ausprobiert werden. Doch worin liegen die Unterschiede?
In den Rahmenvorgaben, die zwischen dem GKV-Spitzenverband und der Kassenärztlichen Bundesvereinigung vereinbart wurden, werden Simvastatin und Pravastatin als Leitsubstanzen der HMG-CoA-Reduktasehemmer definiert. Dabei birgt gerade Simvastatin ein hohes Interaktionspotenzial und Patienten scheinen vermehrt unter Muskelbeschwerden zu leiden. Die schlechteste Inzidenz ist für 80 mg Simvastatin pro Tag in der Literatur belegt. Die Fachinformationen behandeln die Gefahr der Myopathie/Rhabdomyolyse umfassend und empfehlen die Maximaldosierung von 80 mg nur für Patienten mit besonders hohem kardiovaskulärem Risiko. Auch das potentere Atorvastatin interagiert mit dem Cytochrom-P450-System, allerdings in weitaus geringerem Ausmaß als Simvastatin. Es wird oft gut vertragen, auch wenn keine Regelhaftigkeit besteht. Als weiterer Pluspunkt wird eine ausgeprägte antiinflammatorische Wirkung ins Feld geführt. Atorvastatin senkte den Wert des C-reaktiven Proteins in Studien um mehr als 30%, Simvastatin im Vergleich um weniger als 20%.
Pravastatin und Fluvastatin haben den Vorteil, dass sie CYP-unabhängig abgebaut werden, sodass Interaktions-bedingte Komplikationen keine Gefahr darstellen. Sie zählen zu den niederpotenten Statinen: Die Wirkpotenz steigt von Fluvastatin < Pravastatin < Lovastatin < Simvastatin < Atorvastatin < Rosuvastatin. So kann mit 40 mg Fluvastatin in etwa eine LDL-Cholesterol-Senkung wie mit 5 mg bis 10 mg Atorvastatin erzielt werden. Das mit Abstand potenteste Statin ist Rosuvastatin: 5 mg entsprechen 10 mg Atorvastatin*. Einige Experten meinen, dass nur diese beiden Vertreter überhaupt eine intensive Statin-Therapie zulassen. Ein weiterer Vorteil liegt in ihrer langen Halbwertszeit: Für Atorvastatin (14 Stunden) und Rosuvastatin (19 Stunden) bedeutet eine Einnahme seltener als einmal täglich keinen wesentlichen Wirkungsverlust. Dieses Schema kann allerdings die Einnahmetreue gefährden und entspricht nicht der zugelassenen Anwendung, für die ein kardiovaskulärer Nutzen zweifelsfrei nachgewiesen wurde. Die Hoffnung, dass hydrophile Statine wie Rosuvastatin oder Pravastatin eine höhere Hepatoselektivität aufweisen und seltener Statin-assoziierte Muskelsymptome hervorrufen als lipophile Vertreter, erfüllt sich in der klinischen Praxis meist nicht. Ein Wechsel ist dennoch anzuraten. Vor dem Hintergrund eines Genpolymorphismus, der zum Risiko für Statin-assoziierte Muskelsymptome beiträgt, weiß man, dass der Einfluss der SLCO1B1-Variante auf die Plasmakonzentrationen von Statinen in folgender Reihenfolge abnimmt: Simvastatin, Atorvastatin, Pravastatin, Rosuvastatin, Fluvastatin. Eine routinemäßige Bestimmung des Genstatus wird jedoch nicht empfohlen.
* In der Print-Ausgabe ist uns bedauerlicherweise ein Fehler bei der mg-Angabe unterlaufen. Diesen Wert haben wir in diesem online-Artikel korrigiert.
Verträglich, aber unzureichend wirksam
Die Dosistitration kostet Zeit. Für jede Steigerung der Dosierung müssen mindestens zwei Wochen abgewartet werden. Andersherum darf die Statin-Therapie bei Patienten mit hohem Risiko nicht länger als sechs Wochen unterbrochen werden, da sonst kardiovaskuläre Ereignisse drohen. Falls mit der maximal verträglichen Statin-Dosis das LDL-Cholesterol nicht ausreichend gesenkt werden kann, ist eine Kombinationstherapie mit anderen lipidsenkenden Arzneimitteln, vordergründig mit Ezetimib, indiziert. In Einzelfällen kommen auch Gallensäure-bindende Ionenaustauscher wie Colestyramin und Colesevelam (Cholestagel®) infrage. Fibrate, besonders Gemfibrozil (Gevilon®), können ebenfalls Muskelbeschwerden verursachen und das Risiko für eine Rhabdomyolyse erhöhen. Seit November 2020 erweitert Bempedoinsäure (Nilemdo®) die Optionen bei Dyslipidämie, entweder in Kombination mit Statinen oder bei Unverträglichkeit als Monotherapie oder Fixkombination mit Ezetimib (Nustendi®). Explizit zugelassen zur Anwendung bei Statin-Intoleranz sind auch die Lipidsenker Alirocumab (Praluent®) und Evolocumab (Repatha®), deren Wirkung auf Hemmung des Enzyms PCSK9 (Proproteinkonvertase Subtilisin Kexin Typ 9) beruht. |
Literatur
Alonso R et al. Diagnosis and Management of Statin Intolerance. J Atheroscler Thromb 2019;26:207-215
Blasius H. Von kleinen Unterschieden: Statine sind nicht alle gleich. DAZ 2015, Nr. 12, S. 26, 19. März 2015
Gemeinsame Stellungnahme der DGFF (Lipid-Liga) und der D.A.CH.-Gesellschaft Prävention zu einem Schreiben der BARMER vom März 2021 an Ärztinnen und Ärzte, verfügbar unter www.lipid-liga.de/wp-content/uploads/Stellungnahme_DGFF_DACH_zum-Schreiben-der-Barmer_final_19.04.2021.pdf , Abruf am 11. August 2021
Frances A et al. N-of-1 Trial of a Statin, Placebo, or No Treatment to Assess Side Effects. N Engl J Med 2020;383:2182-2184
Laufs U et al. Behandlungsoptionen bei Statin-assoziierten Muskelbeschwerden. Dtsch Arztebl Int 2015;112:748-55; doi: 10.3238/arztebl.2015.0748
Mach F et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J 2019; doi:10.1093/eurheartj/ehz455
Rudolph H. Sind wirklich alle Statine gleich und einfach austauschbar? Meldung der Ärztezeitung vom 25.Oktober 2004, verfügbar unter www.aerztezeitung.de/Medizin/Sind-wirklich-alle-Statine-gleich-und-einfach-austauschbar-326172.html , Abruf am 11. August 2021
Schatz U. Wie diagnostiziert man eine Statinintoleranz? Medizinische Kurznachrichten der Deutschen Gesellschaft für Endokrinologie vom 7. Juni 2021, verfügbar unter https://blog.endokrinologie.net/statinintoleranz-4874/ (letzter Aufruf am 11. August 2021)
S1-Leitlinie „Diagnostik und Differenzialdiagnose bei Myalgien“, Herausgegeben von der Kommission Leitlinien der Deutschen Gesellschaft für Neurologie (DGN), Stand: Februar 2020, AWMF-Registriernummer: 030/051
The European Atherosclerosis Society. Update of SAMS Consensus 2017, verfügbar unter https://www.eas-society.org/page/update_sams_paper (letzter Aufruf am 11. August 2021)
Simvastatin längst nicht mehr 1. Wahl
DAZ: Professor Laufs, in welcher Reihenfolge setzen Sie die einzelnen Statine in der Praxis ein?
Laufs: Zur Verträglichkeit von verschiedenen Statinen bei Statin-assoziierten Muskelschmerzen liegen keine vergleichenden Studien vor. Da die Mehrheit der Beschwerden durch Nocebo-Effekte bedingt ist, kommt der Adhärenzförderung eine entscheidende Rolle zu. Es ist sehr wichtig, dass Statine in der Apotheke positiv kommuniziert werden. Wenn ein Statin-Präparat einmal negativ belegt ist, kann ein Wechsel des Präparats einen Neustart ermöglichen. Wir setzen aus Erwägungen der Wirksamkeit, der Studienlage, der Pharmakologie und der aktuellen KV-Richtlinien Atorvastatin als primäres Statin ein. Die nächste Alternative ist Rosuvastatin.
DAZ: Gibt es Patienten, für die Simvastatin als Erstoption von vorneherein nicht infrage kommt?
Laufs: Simvastatin ist aus meiner Sicht für Neuverschreibungen obsolet, da Atorvastatin und Rosuvastatin bezüglich der Wirksamkeit, der Halbwertszeit und des Abbaus überlegen sind. Wenn Simvastatin schon in der Medikation und ausreichend effektiv ist, sollte es weitergeführt werden. Ansonsten verschreibe ich Simvastatin nur noch in Ausnahmefällen.
DAZ: Wie viel Zeit vergeht in der Regel, bis eine Statin-Intoleranz diagnostiziert und andere lipidsenkende Arzneistoffe zum Einsatz kommen?
Laufs: Diese wichtige Frage ist letztlich offen. Viele Therapieeinstellungen erfordern sehr viel Zeit und Aufwand. Um diese und viele andere wichtige Fragen zu Patienten mit Statin-Intoleranz zu beantworten, haben wir ein prospektives Register zu dem Thema initiiert.
DAZ: Welche Rolle spielen Lovastatin und Pitavastatin im klinischen Alltag?
Laufs: Beide spielen in Deutschland kaum eine Rolle. Das alte Lovastatin ist nicht sehr wirksam. Pitavastatin wird vor allem in Japan verwendet.
DAZ: Welches ist aus Ihrer Erfahrung das am besten verträgliche Statin?
Laufs: Der entscheidende Faktor für die Verträglichkeit ist die Kommunikation von Arzt und Apotheker, nicht das Präparat. Ich persönlich setze primär Atorvastatin und Rosuvastatin ein.
DAZ: Vielen Dank für das Gespräch!


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.