
Thema: EU
Europäische Kommission
CHMP empfiehlt Siponimod bei sekundär progredienter MS
Der Humanarzneimittelausschuss der EMA empfiehlt, Siponimod zur Behandlung Erwachsener mit sekundär progredienter MS auch in der EU zuzulassen. In den USA gibt es Mayzent bereits seit März 2019. ... » Weiterlesen

Arzneimittel in der Umwelt – Apothekerverband stellt Forderungen
Umweltschutz sollte auch bei Arzneimitteln großgeschrieben werden, und zwar nicht nur bei der Herstellung, sondern auch beim Umgang mit nicht verwendeten Medikamenten. Der europäische ... » Weiterlesen
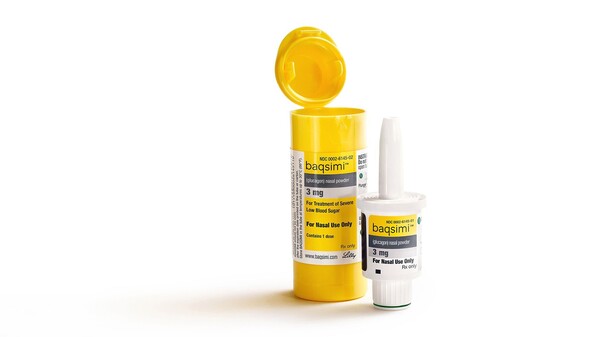
Glucagon in Baqsimi: nasal statt Injektion
Die Therapie schwerer Hypoglykämien bei Diabetikern wird einfacher: Der CHMP empfiehlt, Baqsimi Nasenpulver auch in der EU zuzulassen. Es ist das erste Notfall-Glucagon, das nicht injiziert ... » Weiterlesen

EMA empfiehlt neues Fluorchinolon Delafloxacin zur Zulassung
Der CHMP der EMA kommt beim neuen Fluorchinolon Delafloxacin zu einem positiven Ergebnis und empfiehlt die Zulassung von Quofenix. Delafloxacin wird als intravenöse Infusion und als perorale Tablette... » Weiterlesen

275.000 Euro für Kymriah
cha | Der Schweizer Pharmakonzern Novartis und der GKV-Spitzenverband haben für die CAR-T-Zelltherapie Kymriah®einen Erstattungsbetrag von 275.000 Euro vereinbart » Weiterlesen

EU lässt CBD-Arzneimittel zu
Die Europäische Kommission hat das Orphan Drug Epidyolex zugelassen. Die Cannabidiol-Lösung zum Einnehmen wird aus Cannabispflanzen gewonnen und enthält hochreines CBD. Eingesetzt wird Epidyolex ... » Weiterlesen

Schwangere MS-Patientinnen dürfen Interferon beta erhalten
Interferon beta könnte bald eine Behandlungsoption für schwangere Patientinnen mir Multipler Sklerose sein. Der Humanarzneimittelausschuss CHMP der Europäischen Arzneimittel-Agentur EMA empfiehlt, ... » Weiterlesen
CBD-Präparat Epidyolex auch in Europa zur Zulassung empfohlen
Der Humanarzneimittelausschuss der EMA empfiehlt, Cannabidiol beim Dravet-Syndrom und dem Lennox-Gastaut-Syndrom zuzulassen. In den Vereinigten Staaten dürfen die beiden seltenen und schweren ... » Weiterlesen
Isotretinoin: Hunderte Schwangerschaften trotz Verhütungsprogramm
Isotretinoin ist teratogen. Deshalb gelten nicht nur in Deutschland besondere Auflagen bei der Verordnung für Frauen im gebärfähigen Alter. Erst vor etwa einem Jahr hatte die Europäische ... » Weiterlesen
G-BA bestätigt Zusatznutzen für Fingolimod
Novartis erhielt im November 2018 eine Zulassungserweiterung für Fingolimod (Gilenya): Seither darf Fingolimod auch bei Kindern ab zehn Jahren mit hochaktiver schubförmig-remittierender multipler ... » Weiterlesen

Sind 75 Prozent der rezeptfreien Arzneimittel geeignet?
„Nie mehr unvorbereitet in die Apotheke“ wirbt Stiftung Warentest für ihre Datenbank „Medikamente im Test“. Neu ist die Medikamentenberatung der Verbraucherschützer nicht, von Zeit zu Zeit ... » Weiterlesen
Dupilumab als Add-On bei schwerem Asthma mit Typ-2-Inflammation
Vor einem Monat hat die Europäische Kommission den dualen Antikörper Dupilumab (Dupixent) von Sanofi in den Dosierungen 200 mg und 300 mg pro Fertigspritze bei Asthma zugelassen. Während die hö... » Weiterlesen

Glyphosat in aller Munde
Gibt man bei der Internet-Suchmaschine Google den Begriff „Glyphosat“ ein, so wird man aktuell mit ungefähr 2,5 Millionen Treffern beliefert [1]. Der entsprechende Wikipedia-Eintrag umfasst ... » Weiterlesen

Wegen fehlender Wirksamkeit: Zulassung für Lartruvo wird widerrufen
Der monoklonale Antikörper Olaratumab (Lartruvo) hat seine Zulassungsauflagen nicht erfüllt: Die Wirksamkeit wurde in der Phase-III-Studie beim fortgeschrittenen Weichteilsarkom nicht bestätigt. ... » Weiterlesen

Xarelto- und Eliquis-Antidot zugelassen
Am 1. März 2019 hatte die europäische Arzneimittelbehörde EMA die Zulassung für das Apixaban- und Rivaroxaban-Antidot Andexanet alfa empfohlen. Dieser Empfehlung ist die Europäische Kommission ... » Weiterlesen
Soll man Fluorchinolone noch verordnen – und wenn ja, wann?
Mit Fluorchinolonen wurde in der Vergangenheit in der Versorgungspraxis zu leichtfertig umgegangen. Nicht für jede bislang zugelassene Indikation ist vor dem Hintergrund potenzieller Nebenwirkungen ... » Weiterlesen
Opioid-Sucht: EU-Zulassungsempfehlung für Buprenorphin-Implantat
Für stabil eingestellte Opioidabhängige könnte sich die Substitutionsbehandlung demnächst vereinfachen: Der EMA-Ausschuss für Humanarzneimittel hat die Zulassung des Buprenorphin-Implantats Sixmo... » Weiterlesen

Seqirus liefert Grippeimpfstoffe im Pandemiefall
Der Grippeimpfstoffhersteller Seqirus hat mit der Europäischen Kommission die ersten europäischen Rahmenverträge zur Bereitstellung von Influenza-Impfstoffen im Pandemiefall geschlossen. Seqirus ... » Weiterlesen
Roches Rituximab erhält EU-Zulassung bei Pemphigus Vulgaris
Die Europäische Kommission hat Mabthera® bei Pemphigus Vulgaris zugelassen. Roches Biologikum Rituximab erhält damit auch in der EU eine Zulassungserweiterung für die seltene, blasenbildende und ... » Weiterlesen

Risankizumab bei Plaque-Psoriasis
Für mittelschwere bis schwere Plaque-Psoriasis könnte bald ein neues Arzneimittel die Therapie erwachsener Schuppenflechtepatienten erweitern. Der CHMP, der Humanarzneimittelausschus der EMA, hat im... » Weiterlesen

Strengere Regeln und klare Verhältnisse für bilanzierte Diäten
Ab dem 22. Februar 2019 gilt eine spezielle europäische delegierte Verordnung, mit der die Vorgaben für Lebensmittel für besondere medizinische Zwecke (bilanzierte Diäten) verschärft werden. ... » Weiterlesen

Was sich jetzt ändert
Zum Randsortiment in Apotheken gehören auch diätetische Lebensmittel. Der Sektor wurde auf europäischer Ebene in den letzten Jahren neu geordnet. Ab dem 22. Februar 2019 gilt eine spezielle ... » Weiterlesen

Zirabev erhält EU-Zulassung
Roches Avastin® bekommt Konkurrenz: Pfizer hat die EU-Zulassung für das Bevacizumab-Biosimilar Zirabev® erhalten. Bevacizumab hemmt den VEGF (vascular epidermal growth factor) und wird unter ... » Weiterlesen

Licht und Schatten von Dapagliflozin
Mit Dapagliflozin könnte das erste orale Antidiabetikum zur Add-on-Therapie bei Diabetes mellitus Typ 1 zugelassen werden. Die entsprechende Empfehlung des Ausschusses für Humanarzneimittel (CHMP) ... » Weiterlesen

Sartane: Risikobewertungsverfahren ist abgeschlossen
Pharmazeutische Unternehmer müssen zukünftig das Vorhandensein von NDMA- oder NDEA-Verunreinigungen in Sartanen ausschließen können. Allerdings erst nach einer Übergangsfrist von zwei Jahren. So ... » Weiterlesen




















Foto: finecki / Fotolia