SARS-CoV-2-Antikörper
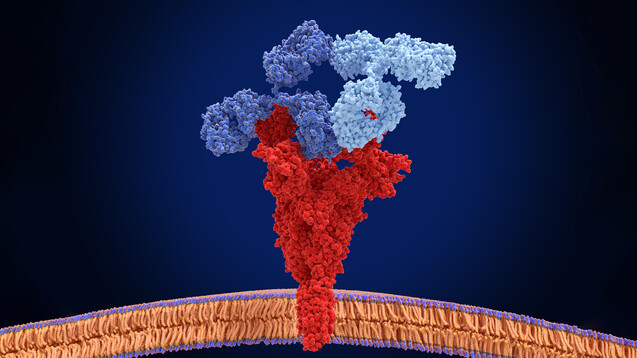
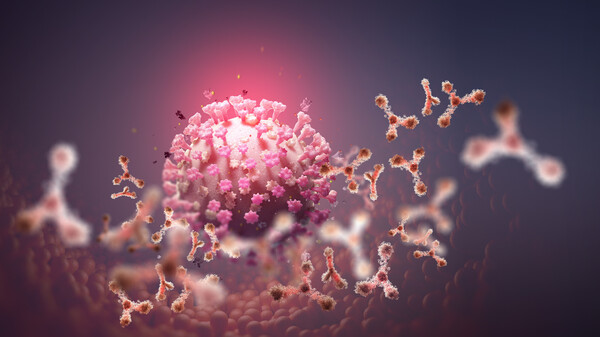
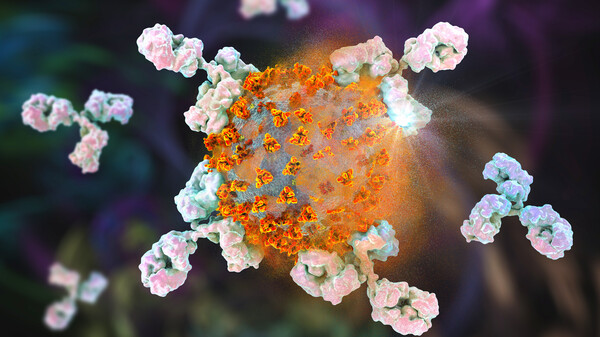
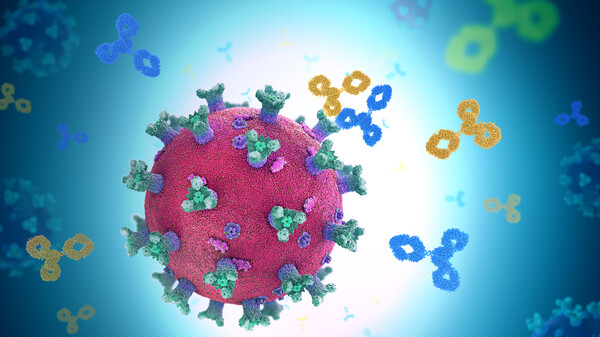
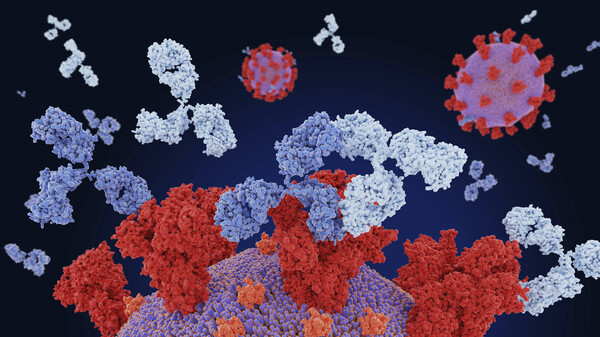
Antikörper gegen SARS-CoV-2 sollen das Virus abfangen und neutralisieren. Sie werden parenteral verabreicht und binden an SARS-CoV-2, inaktivieren das Virus und verhindern so, dass SARS-CoV-2 menschliche Zellen infizieren, sich vermehren und ausbreiten kann. Zielstruktur ist das Spikeprotein von SARS-CoV-2: Durch Bindung an das Spikeprotein blockiert der Antikörper die Interaktion des Virus mit dem Angiotensin-konvertierenden Enzym 2 [ACE2] und damit das Eindringen des Virus in die menschliche Zelle.
Vorbild für die therapeutischen Antikörper gegen Corona sind meistens „Original“-Antikörper aus dem Blut von bereits mit SARS-CoV-2 infiziert gewesenen Patienten, die mittlerweile genesen sind. Die Idee ist durchaus klug, haben diese Antikörper wohl dazu beigetragen, dass der COVID-19-Patient wieder gesund wurde. Der Körper bildet bei einer SARS-CoV-2- Infektion allerdings nicht nur eine einzige Sorte von Antikörpern. Die Frage ist also: Welcher von diesen entnommenen Antikörpern ist der beste? Um das herauszufinden, prüfen Wissenschaftler im Labor zunächst, welche der entnommenen Antikörper besonders effektiv gegen SARS-CoV-2 wirken. Diese Antikörper werden sodann weiterentwickelt und optimiert, beispielsweise auch dahingehend, dass sie eine längere Halbwertszeit und Wirkdauer haben.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.