
- DAZ.online
- News
- Pharmazie
- Comirnaty-Booster nicht f...
FDA genehmigt Auffrischimpfung
Comirnaty-Booster nicht für jeden
Stuttgart - 23.09.2021, 09:15 Uhr
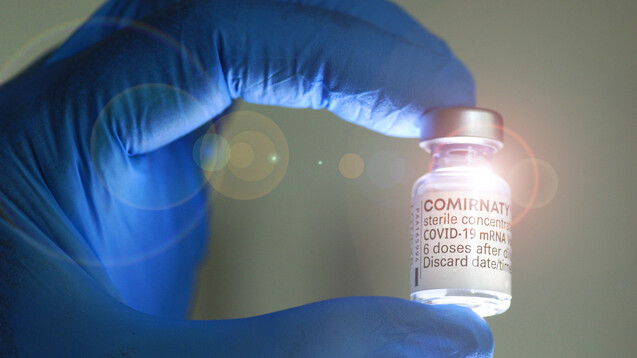
Die FDA genehmigte eine Pfizer/Biontech-Auffrischimpfung für ab 65-Jährige, ab 18-Jährige mit hohem Risiko für eine schwere COVID-19-Erkrankung und mit beruflicher Exposition gegenüber SARS-CoV-2. (Foto: IMAGO / CHROMORANGE)
Mehr geschwollene Lymphknoten
Zur Sicherheit der Auffrischungsdosis gibt es Daten von 306 Studienteilnehmern zwischen 18 und 55 Jahren sowie zwölf weiteren ab 65-Jährigen. Sie wurden nach der Impfung im Durchschnitt zwei Monate lang nachbeobachtet. Am häufigsten berichteten die Geimpften über Schmerzen, Rötungen und Schwellungen an der Injektionsstelle und Müdigkeit, Kopfschmerzen, Muskel- oder Gelenkschmerzen und Schüttelfrost. Bemerkenswert sei, erklärt die FDA, dass geschwollene Lymphknoten in der Achselhöhle nach der Auffrischungsdosis häufiger beobachtet wurden als nach der ersten Serie von zwei Dosen.
„Die heutige Maßnahme zeigt, dass die Wissenschaft und die derzeit verfügbaren Daten weiterhin die Entscheidungsgrundlage der FDA für COVID-19-Impfstoffe während dieser Pandemie bilden. Nach Abwägung der Gesamtheit der verfügbaren wissenschaftlichen Beweise und der Überlegungen unseres beratenden Ausschusses unabhängiger, externer Experten hat die FDA die EUA für den COVID-19-Impfstoff von Pfizer/Biontech geändert, um eine Auffrischungsdosis für bestimmte Bevölkerungsgruppen wie Mitarbeiter des Gesundheitswesens, Lehrer und Kindertagesstättenpersonal, Beschäftigte in Lebensmittelbetrieben und in Obdachlosenunterkünften oder Gefängnissen zuzulassen“, sagte die amtierende FDA-Kommissarin Janet Woodcock, M.D..



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.