
- DAZ.online
- News
- Schweiz nun wie ...
Neue Ära durch die MDR eingeläutet
Schweiz nun wie Drittstaat behandelt: Ist die Diabetikerversorung gefährdet?
Remagen - 31.05.2021, 12:26 Uhr
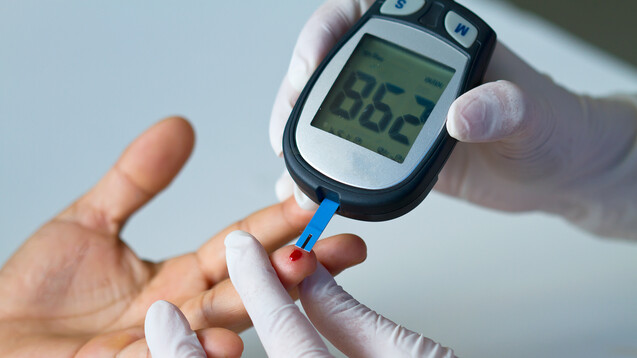
Große schweizerische Hersteller von Blutzuckerteststreifen, Glukosemessgeräten und -systemen oder auch Insulinpumpen haben den deutschen und den gesamten EU-Markt bisher reibungslos bedient. Nun gilt das Land als Drittstaat. (c / Foto: pittawut / AdobeStock)
Mit dem Inkrafttreten der europäischen Medizinprodukteverordnung (MDR) werden im Medtech-Markt der EU die Karten neu gemischt. Der Übergang ist für alle Beteiligten ein riesiger Kraftakt. Nun kommen auch noch Probleme mit der Schweiz hinzu. Bislang waren beide Medizinprodukte-Märkte über ein Abkommen zur gegenseitigen Anerkennung (MRA) quasi eins, aber das ist jetzt vorbei, und am Verhandlungstisch herrscht „Eiszeit“. Die Versorgung von Diabetikern ist zum Beispiel ein Sektor, der von der neuen Situation betroffen sein könnte.
Seit wenigen Tagen gilt in der EU die neue Medizinprodukte-Verordnung (MDR). Der Branchenverband BVMed, der rund 230 Hersteller und Zulieferer der Medizintechnik-Branche sowie Hilfsmittel-Leistungserbringer und Homecare-Versorger vertritt, „feierte“ den Geltungsbeginn mit der ersten MDR-Branchenkonferenz der BVMed-Akademie.
Mit der MDR bekomme Europa nun die schärfste Regulatorik für Medizinprodukte in der Welt, sagte der BVMed-Vorstandsvorsitzende Dr. Meinrad Lugan in seiner einführenden Rede zu der Tagung. „Sie droht unsere innovative Branche auszubremsen – mit katastrophalen Folgen für die Patientenversorgung und für den MedTech-Standort in Deutschland und Europa.“ Lugan fordert angesichts dessen eine strategische Weiterentwicklung der MDR, schnelle und pragmatische Lösungen sowie eine bessere Unterstützung der kleinen und mittelständischen Unternehmen, die die Branche so nachhaltig prägen.
Kein Bestandsschutz für bewährte Produkte
Womit es die Medtech-Industrie ab jetzt zu tun bekommt, legte die Leiterin des Referats Regulatory Affairs und stellvertretende Geschäftsführerin des BVMed Dr. Christina Ziegenberg dar. Insgesamt würden die Regeln deutlich umfangreicher, so Ziegenberg. Während das bisherige deutsche Medizinproduktegesetz (MPG) mit 44 Paragrafen ausgekommen sei, umfasse die EU-Verordnung 123 Artikel und 17 Anhänge mit insgesamt 175 Seiten. Als besonders problematisch stellte sie heraus, dass es für bewährte Produkte am Markt keinen Bestandsschutz gibt. Leider seien die Übergangsfrist für die Gültigkeit der Altzertifikate, die sogenannte „Grace Period“, bis Mai 2024 und die Abverkaufsfrist bis Mai 2025 nicht analog zur Verschiebung des Geltungsbeginns der MDR angepasst worden, trotz der Auswirkungen der Corona-Pandemie. Die zu erwartenden Engpässe bei der Neuzertifizierung bleiben deshalb ihrer Einschätzung nach nicht nur bestehen, sondern haben sich sogar noch verstärkt. Ziegenberg glaubt jedenfalls nicht, dass die rund 20.000 Zertifikate bis zum Ende der Übergangsperiode im Mai 2024 tatsächlich in die MDR überführt werden können.
Gemeinsamer Markt über die gegenseitige Anerkennung
Der Geltungsbeginn der MDR hat aber noch eine weitere dramatische Implikation, und zwar für den freien Handel mit Medizinprodukten zwischen der EU und der Schweiz. Mit ihm gehören die Handelserleichterungen für Medizinprodukte zwischen beiden bis auf weiteres der Vergangenheit an. Wie ist es dazu gekommen?
Im Jahr 2002 traten die sogenannten Bilateralen I in Kraft, die den Boden für den erleichterten gegenseitigen Zugang zu den Arbeits-, Waren- und Dienstleistungsmärkten der EU und der Schweiz vorsahen. Sie beinhalten unter anderem ein Abkommen über die gegenseitige Anerkennung (Mutual Recognition Agreement, MRA) zum Abbau technischer Handelshemmnisse. Hiernach sollte der grenzüberschreitende Warenverkehr für 20 Produktbereiche erheblich vereinfacht werden, darunter auch für Medizinprodukte, wobei für die gemeinsamen Standards explizit auf die EU-Richtlinien über Medizinprodukte und In-vitro-Diagnostika abgehoben wurde. Die Anpassung an die MDR wurde bisher nicht vorgenommen.
InstA gescheitert
Seit dem Jahr 2014 verhandelten die EU und die Schweiz dann über ein Institutionelles Rahmenabkommen (InstA), mit dem die Bilateralen I und II sowie weitere Abkommen konsolidiert werden sollen. Dieses sollte auf der dynamischen Übernahme von neuem EU-Recht basieren, sodass die bisherigen Anpassungen und Vertragsüberarbeitungen entfallen würden. Das InstA ist jedoch bislang trotz langer Verhandlungen nicht zustande gekommen, und die EU hatte stets klargestellt, dass es ohne eine Einigung über das InstA auch keine Aktualisierung des Abkommens über die gegenseitige Anerkennung (MRA), einschließlich des Kapitels über Medizinprodukte, geben könne. Nachdem die Schweiz die Verhandlungen über das Rahmenabkommen am Mittwoch letzter Woche, den 26. Mai 2021, wegen weiterhin bestehender „substantieller Differenzen“ abgebrochen hatte, war das Schicksal der Medizinprodukte mit Blick auf das MRA einmal mehr besiegelt. Weil es wegen der fehlenden Anpassung weiterhin auf die nicht mehr geltenden EU-Richtlinien referenziert, gilt die MDR in der Schweiz nicht, und somit gibt es auch keine Basis mehr für die Handelserleichterungen.
Verhärtete Fronten
Die EU geht aktuell nicht davon aus, dass es durch die neue Situation während der COVID-19-Pandemie große Störungen im Gesundheitssektor geben wird. Trotzdem hatte sie der Schweiz am 30. März vorsorglich eine begrenzte Änderung des Abkommens über die gegenseitige Anerkennung vorgeschlagen. Damit sollte für bestehende schweizerische Konformitätsbescheinigungen ein Übergangszeitraum bis höchstens 26. Mai 2024 eingeräumt werden, und auch bestehende in der EU ausgestellte Bescheinigungen sollten so lange gültig bleiben. Auch hierüber konnte jedoch bisher keine Einigung erzielt werden.
Schweiz wahrscheinlich stärker betroffen
Die Schweiz exportiert 46 Prozent ihrer Medizinprodukte in die EU und importiert 54 Prozent aus der EU. Zum Vergleich: Die EU führt 10 Prozent der Medizinprodukte aus der Schweiz ein und nur 5 Prozent der Medizinprodukte in die Schweiz aus. Die „Ärzte Zeitung“, die das Thema ebenfalls aufgegriffen hat, nennt die Versorgung von Diabetikern als Beispiel für einen Sektor, der von der neuen Situation betroffen sein könnte. Große schweizerische Hersteller von Blutzuckerteststreifen, Glucosemessgeräten und -systemen oder auch Insulinpumpen hätten den deutschen und den gesamten EU-Markt bisher reibungslos bedient, berichtet die Zeitung.
Auf „Drittstaat“ zurückgestuft
Der schweizerische Branchenverbandes Swiss MedTech gibt sich indessen relativ gelassen, denn damit sei eingetroffen, was sich bereits vor zwei Jahren als mögliches Szenario abgezeichnet habe, heißt es in einer Pressemitteilung, die Rückstufung der Schweizer Medizintechnikbranche auf „Drittstaat“. Zwar müssten Schweizer Unternehmen für den Export ihrer Medizinprodukte in die EU ab sofort erhöhte Anforderungen erfüllen, aber man habe sich „mit großem Einsatz so gut wie möglich auf diesen Tag vorbereitet“. Mit Enttäuschung nimmt Swiss Medtech allerdings zur Kenntnis, dass sich die Schweiz und die EU bis heute nicht auf eine gemeinsame Interpretation des geltenden MRA und entsprechende Übergangsbestimmungen für Medizinprodukte mit Altzertifikaten geeinigt haben. „Wir hoffen, dass das letzte Wort noch nicht gesprochen ist“, sagt der Präsident von Swiss Medtech, Beat Vonlanthen. „An einer pragmatischen Lösung, um die lückenlose Patientenversorgung in der Schweiz und in der EU aufrechtzuerhalten, müssen beide Seiten interessiert sein.“ Vonlanthen erwartet von der Politik, dass sie die Gesundheitsversorgung ihrer eigenen Bevölkerung über verhandlungstaktische Interessen stellt.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.