
- DAZ.online
- News
- Pharmazie
- Optimales Zeitfenster ...
ReKonvaleszentenplasma gegen SARS-CoV-2
Optimales Zeitfenster sehr wichtig für die Spende
Remagen - 03.03.2021, 10:45 Uhr
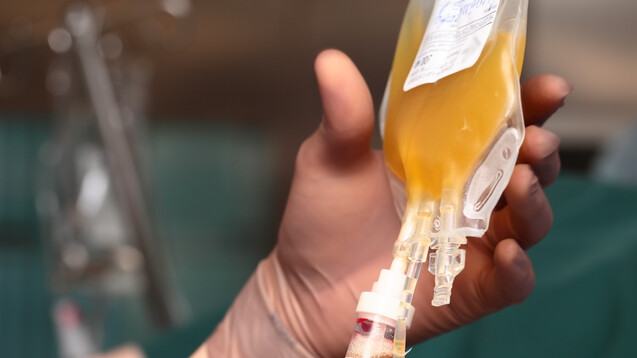
Derzeit tastet sich die Wissenschaft heran, um zu definieren, welches Plasma am „wertvollsten“ ist und wann dieses entnommen werden sollte, damit die gewünschten Antikörper-Titer gegen COVID-19 auch hoch genug sind. (Foto: sudok1 / stock.adobe.com)
Starke Immunantwort über 140 Tage
„Unsere Feststellung, dass eine starke Immunantwort bei den meisten COVID-Patienten 140 Tage nach Auftreten der Symptome anhält, war unerwartet und widerspricht den Behauptungen einer kurzlebigen Immunität und einer möglichen Reinfektion einiger COVID-Patienten", kommentiert Suresh Kuchipudi, klinischer Professor für Veterinär- und Biomedizinwissenschaften an der Penn State, die neue Erkenntnis. Die Forschung zeigte auch, dass der ideale Rekonvaleszenzplasma-Spender ein genesener COVID-19-Patient ist, der älter als 30 Jahre ist und dessen Krankheit schwerwiegend war.
In einer vorherigen Studie hatten Kuchipudi und seine Kollegen festgestellt, dass fast 40 Prozent der von ihnen untersuchten Spender nicht über die erforderlichen Titer an virusneutralisierenden Antikörpern verfügten, um die Immunität an andere weiterzugeben, wahrscheinlich weil das optimale Zeitfenster für die Spende abgelaufen war. „Dies ist besonders wichtig, wenn man bedenkt, dass bis heute mehr als 100.000 COVID-19-infizierte Personen in den USA Rekonvaleszenzplasma-Spenden von erholten Patienten erhalten haben", meint der Penn State-Wissenschaftler.
Sein Kollege Vivek Kapur, Professor für Mikrobiologie und Infektionskrankheiten, resümiert: „Zusammengenommen legen unsere Ergebnisse nahe, dass sorgfältig ermittelt werden sollte, welche wiederhergestellten Patienten als Spender qualifiziert sind, und dass diese Spender, wenn sie sich für eine Spende entscheiden, dies schnell tun sollten, bevor ihre wertvollen VN-Antikörper nachlassen.“
Problematische Analytik
Die Autor:innen stellen weiterhin fest, dass die virusneutralisierenden Antikörper mit aktuellen Antikörpertests schwer nachzuweisen waren. In einem kürzlich im „Journal of Clinical Investigation“ veröffentlichten Artikel berichtete das Team jedoch über die Ergebnisse einer anderen Studie, die einen Lösungsweg dafür aufzeigt. Sie hatte ergeben, dass die VN-Titer mit bestimmten Arten von IgG-Antikörpern korrelieren. Die Titer dieser IgG-Antikörper könnten wiederum mithilfe von ELISA-Assays oder enzymgekoppelten Immunosorbens-Assays schneller und einfacher bestimmt werden, eine Möglichkeit, um die herausfordernde Analytik zu umgehen.
Was steht in der Notfallgenehmigung der USA-FDA?
Die US-Food and Drug Administration hatte bereits am 23. August 2020 eine Genehmigung für den Notfalleinsatz (EUA) von Rekonvaleszenzplasma zur Behandlung von COVID-19 bei Krankenhauspatienten erteilt. Ende November stellte die FDA fest, dass die Transfusion von Plasma von Genesenen in einer späten Phase des Krankheitsverlaufs keinen klinischen Nutzen gebracht hat und aktualisierte das Fact-Sheet für Gesundheitsdienstleister entsprechend. Anfang Februar wurden in Inhalte der Notfallgenehmigung basierend auf weiteren Daten erneut revidiert. So wurde die Verwendung auf COVID-19-Rekonvaleszenzplasma mit einem hohen Antikörper-Titer beschränkt, weil Qualitäten mit einem niedrigen Titer sich nach neueren klinischen Studien nicht als hilfreich erwiesen haben. Die EUA gilt demnach aktuell für die Behandlung von Krankenhauspatienten mit COVID-19 zu Beginn des Krankheitsverlaufs, deren humorale Immunität beeinträchtigt ist und die selbst keine adäquate Antikörperantwort produzieren können. Sie enthält neun Tests, mit denen Plasmaspenden auf Anti-SARS-CoV-2-Antikörper untersucht werden können, um ihre Eignung zu bestimmen.
Therapie auch in der EU praktiziert
Auch in der Europäischen Union wird Plasma von COVID-19-Genesenen notfallmäßig eingesetzt. Die EU-Kommission hat bereits im April 2020 Leitlinien für die Sammlung und Transfusion von COVID-19-Rekonvaleszenzplasma veröffentlicht. Diese wurden zuletzt am 1. Dezember 2020 aktualisiert (Version 3.0). Die Leitlinien sollen in den Mitgliedstaaten einen einheitlichen Ansatz im Hinblick auf Spenden, Sammlung, Tests, Verarbeitung, Lagerung, Verteilung und Überwachung von Rekonvaleszenzplasma für die Behandlung von COVID-19-Patienten fördern. Sie wurden in Zusammenarbeit mit dem Europäischen Zentrum für die Prävention und die Kontrolle von Krankheiten (ECDC) entwickelt und von den Behörden der 27 Mitgliedstaaten gebilligt, die vor Ort für Blut und Blutbestandteile zuständig sind. Außerdem unterhält die Europäische Kommission gemeinsam mit der European Blood Alliance (EBA) eine Datenbank für die Erfassung von Daten über Spenden und Behandlungsergebnisse, um die Nachweise über Sicherheit und Effizienz dieser Therapie aus sämtlichen EU-Quellen zusammenzutragen. Die Inhalte der Datenbank sind frei zugänglich.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.