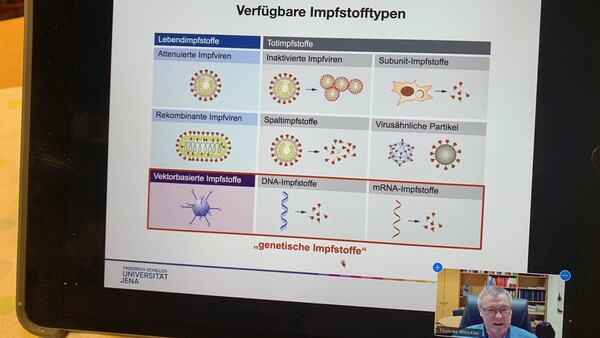
„Der Impfstoffkandidat NVX-CoV2373 ist ein Präfusionsprotein, das unter Verwendung der rekombinanten Nanopartikel-Technologie von Novavax zur Erzeugung von Antigen aus dem Coronavirus-Spike-Protein (S-Protein) hergestellt wird. Um die Immunantwort zu verstärken und hohe Konzentrationen neutralisierender Antikörper zu stimulieren, wird der Impfstoffkandidat mit dem patentierten Matrix-M™-Adjuvans auf Saponin-Basis von Novavax kombiniert. NVX-CoV2373 war nach vorklinischen Tests als führender SARS-CoV-2-Kandidat ermittelt worden. Diese hatten eine starke Immunogenität und einen hohen Gehalt an neutralisierenden Antikörpern gezeigt.“
Quelle DAZ.online 29. Mai 2020



























1 Kommentar
Wissenschaftliche Seriosität wahren
von Peter Szillat am 05.02.2021 um 13:51 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.