
- DAZ.online
- News
- Pharmazie
- Tschüss Cytotec! Hallo ...
Misoprostol in der Geburtseinleitung
Tschüss Cytotec! Hallo Angusta?
Stuttgart - 01.02.2021, 17:50 Uhr

Egal ob Angusta noch in diesem Jahr auf den deutschen Markt kommt – Cytotec soll unabhängig davon nicht zur Geburtseinleitung verwendet werden, da die Dosierung mit 200 µg viel zu hoch ist, meint die DGGG. (Foto: Gorodenkoff / stock.adobe.com)
Wird das im vergangenen Jahr im Rahmen der Geburtseinleitung medial heiß diskutierte „Problem Cytotec“ bald von der Bildfläche verschwinden? Vieles spricht dafür, denn das Präparat Angusta mit dem Wirkstoff Misoprostol wurde bereits letztes Jahr in der entsprechenden Indikation zugelassen. Offenbar muss jetzt nur noch über den Erstattungspreis entschieden werden, bevor Angusta – und damit ein zugelassenes orales Misoprostolpräparat für die Geburtseinleitung – auch tatsächlich auf dem Markt verfügbar wird.
Seit Dezember 2020 gibt es eine neue gemeinsame S2k-Leitlinie der Deutschen, der Österreichischen und der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG, OEGGG, SGGG) zur Geburtseinleitung. DAZ.online berichtete darüber. Ersehnt worden war die Leitlinie (nicht nur) wegen einer zuvor medial geführten Diskussion rund um den Wirkstoff Misoprostol und insbesondere das diesen Wirkstoff enthaltende Arzneimittel Cytotec®, das über keine Zulassung zur Geburtseinleitung verfügt. Allerdings kann auch die neue Leitlinie zum Thema Geburtseinleitung und Misoprostol nicht alle Fragen abschließend beantworten.
Mehr zum Thema

Neue Leitlinie zur Geburtseinleitung
Das „Problem Cytotec“: Optimale Dosierung von Misoprostol weiterhin unklar
So heißt es unter dem Abschnitt „Prostaglandin E1-Analoga (Misoprostol)“ beispielsweise: „Problematisch und weiterhin unklar ist die optimale Dosierung, da eine Erhöhung der Dosis zwar zu einer besseren Effektivität führt, jedoch die Nebenwirkungen (v.a. uterine Überstimulation) ebenso höher sind.“ DAZ.online hat sich bei der DGGG nach den Hintergründen erkundigt.
Keine Arzneimittelstudien zu erwarten
Professor Kehl vom Universitätsklinikum Erlangen erklärte gegenüber DAZ.online, dass der Vergleich verschiedener Dosisregimes Arzneimittelstudien erforderlich machen würde. Was aber nicht zur erwarten sei. Daraus kann man also schlussfolgern, dass es in naher Zukunft keine präzisierten Dosierungsangaben zu Misoprostol geben wird. Abgesehen davon gebe es aber zahlreiche Studien, in denen verschiedene Misoprostol-Dosierungen verwendet wurden, so Kehl. Er verweist dazu auf die Literaturangaben in der Leitlinie.
Entsprechende Studien sind also nicht zu erwarten, aber werden sie von manchen Ärzten nicht doch vermisst? Folgt man Kehls Erklärungen, scheint dem nicht so zu sein: „Da jede Schwangere individuell zu betrachten ist, es verschiedene Geburtssettings und verschiedene Versorgungsstufen gibt, sind rigide einheitliche Dosierungsregimes nicht immer sinnvoll. Es gibt permanent internationale und nationale Studien zur Geburtseinleitung mit verschiedenen Verfahren.“
Datengrundlage fehlt
Im Rahmen der „optimalen Dosierung“ ist auch weiterhin unklar, ob es eine Höchstdosis über 24 Stunden für Misoprostol in der Geburtseinleitung geben sollte. Ist auch dieser offene Punkt damit zu begründen, dass rigide Dosierungsregimes nicht immer sinnvoll sind? Nicht ganz: Laut Kehl gibt es dazu schlichtweg keine Datengrundlage. „Übliche Abstände bei Dosierungen von 25 µg sind 2 Stunden, bei höheren Dosierungen alle 4 Stunden“, erklärt er.
Für die Schweiz wird innerhalb der Leitlinie weiterhin prioritär auf den Expertenbrief der SGGG Nr. 63 verwiesen. Dort heißt es beispielsweise zusätzlich zur Dosierung: Bei oraler Verwendung von Misoprostol oral ist die Dosierung auf 20 – 50 µg alle 2 – 4 Stunden mit maximal 200 – 300 µg/d zu beschränken.
Zulassung von Angusta in Deutschland: die „Repeat-Use Procedure“
Am 17. August 2020 veröffentlichte nun die Firma Norgine B.V. eine Pressemitteilung mit der Botschaft, einen wichtigen Meilenstein in der Zulassung von Angusta® (Misoprostol) in Europa zur oralen Einleitung der Wehen erreicht zu haben. Man habe die sogenannte „Repeat-Use Procedure“ (RUP) in einer Reihe europäischer Länder abgeschlossen: darunter Österreich, Belgien, Zypern, Deutschland, Griechenland, Spanien, Irland, Italien, Luxemburg, Malta, Niederlande, Portugal und Großbritannien. Während den meisten Pharmazeut:innen noch geläufig sein dürfte, was eine Mutual Recognition Procedure (MRP) ist, ist die RUP wahrscheinlich erklärungsbedürftig.
Die DAZ 38/2014 erklärte zur Zulassung in Europa: „Für Arzneimittel, die nicht unter den Anwendungsbereich des zentralen Verfahrens fallen, muss, wenn sie in mehreren Mitgliedstaaten zur Zulassung gebracht werden sollen, entweder das Verfahren der gegenseitigen Anerkennung (MRP) oder das dezentrale Verfahren (DCP) beschritten werden.“ In beiden Verfahren kann der Antragsteller demnach die Länder, in denen er die Zulassung anstrebt, selbst bestimmen. Das BfArM erklärt zusätzlich auf seinem Internetauftritt: „Soll ein Präparat, welches schon ein DCP oder ein erstes MRP durchlaufen hat, in einem oder mehreren weiteren EU-Staaten in den Verkehr gebracht werden, muss zwingend ein weiteres MRP durchgeführt werden. Dieses Verfahren ist bekannt als sogenanntes Repeat Use Procedure (RUP).“
Mehr zum Thema
Teil 2: Europäisches Zulassungssystem, Änderungen an Arzneimitteln nach der Zulassung
Arzneimittelzulassung
Dieses RUP hat Angusta® für Deutschland also erfolgreich durchlaufen. Auf dem Markt verfügbar ist es laut Lauer-Taxe (Stand. 28.01.2021) allerdings nur in Österreich und den Niederlanden durch die Firma Norgine – und in Dänemark durch die Firma Azanta, welche laut der Pressemitteilung kürzlich durch Norgine übernommen wurde. Dementsprechend diente Dänemark – als Mitgliedstaat, in welchem die Zulassung bereits vorlag – auch im Rahmen der RUP automatisch als sogenannter „Reference Member State“.
Abweichend zur Verfügbarkeit laut Lauer-Taxe heißt es in der Norgine-Pressemitteilung, dass Angusta® in Europa bereits 2017 in einer Reihe von nordischen Ländern, Frankreich und zehn weiteren mittel- und osteuropäischen Ländern zugelassen wurde.
Kommt Angusta dieses Jahr in Deutschland auf den Markt?
Die Zulassung von Angusta® in Deutschland wurde offenbar erst nach der Fertigstellung der Leitlinie bekannt, denn dort heißt es noch: „International zugelassene orale Misoprostol-Präparate zur Geburtseinleitung sind in Deutschland aktuell noch nicht zugelassen“. Es findet sich also auch keine Empfehlung zum Präparat Angusta® in der Leitlinie. DAZ.online wollte deshalb von der DGGG erfahren, ob sie in den Fortschritt des Zulassungsprozesses eingebunden ist und man sagen kann, wann Angusta® in Deutschland auch tatsächlich auf dem Markt verfügbar sein wird? Man rechnet damit, dass Angusta® noch 2021 auf den Markt kommen wird.
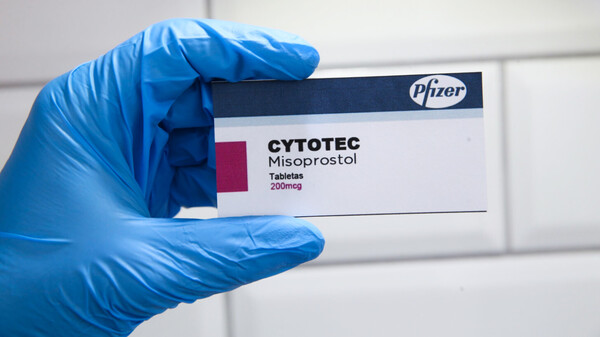
Was das in der Konsequenz für den Einsatz von Cytotec® in der Geburtseinleitung bedeuten wird, dazu hat die DGGG eine klare Position: „Cytotec® soll unabhängig davon nicht zur Geburtseinleitung verwendet werden, da die Dosierung mit 200 µg viel zu hoch ist.“
Aus einem Gespräch mit Professor Abou-Dakn vom St. Joseph Krankenhaus Berlin-Tempelhof erfuhr DAZ.online zudem, wie diese Position der DGGG einzuordnen ist: Es geht in der ganzen Diskussion am Ende nicht um das Präparat Cytotec®, sondern den Wirkstoff Misoprostol, der seinen festen Platz in der Geburtshilfe verdient hat. Über einen wahrscheinlichen Kostenanstieg durch die Markteinführung von Angusta® sollten sich die anwendenden Ärzt:innen keine Gedanken machen, meint Abou-Dakn. Sachkosten, die berechtigt seien, würden am Ende auch bezahlt.
Mehr zum Thema

Misoprostol in Cytotec – Teil 1
Gefährlich oder Lebensretter für Frauen?

Misoprostol in Cytotec – Teil 2
Geburtseinleitung nach Leitlinie – nicht möglich?
Misoprostol in Cytotec – Teil 3
Ein pharmazeutischer Blick auf den Fall Cytotec
Schon im Jahr 2011 hatte ein Expertenbrief der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe die Hintergründe zur Misoprostol-Problematik beleuchtet. Damals äußerte sich schon die finanzielle Problematik: Bei der Verwendung von Misoprostol entstünden nur circa 1 Prozent der Kosten im Vergleich mit registrierten E2-Prostaglandinen, hieß es damals und: „Problematisch ist zurzeit die Off-Label-Anwendung von Misoprostol. Die Tatsache, dass trotz unzähliger Studien zur Wirksamkeit und Sicherheit von Misoprostol (mit Ausnahme weniger Länder) keine Anwendungserweiterung für den Einsatz zur Geburtseinleitung und Atonietherapie beantragt wurde, ist nach unserer Beurteilung weitgehend emotional (das Medikament wird auch für Schwangerschaftsabbrüche verwendet) und – aus Herstellersicht – ökonomisch begründet.“
Mittlerweile klingt es so, als wäre – 10 Jahre später – der Weg für Angusta® in Deutschland geebnet. Die Entscheidung des Gemeinsamen Bundesausschuss (G-BA)* über den Zusatznutzen und die darauf folgende Preisfindung darf also mehr oder weniger entspannt erwartet werden.
* Anmerkung der Redaktion 22.02.2021, 16:55 Uhr
Im ursprünglichen Text hieß es: „Die Entscheidung des Gemeinsamen Bundesausschuss (G-BA) über den Erstattungspreis darf also mehr oder weniger entspannt erwartet werden.“ Der Satz wurde korrigiert, weil der G-BA nicht über den Erstattungspreis entscheidet, sondern lediglich über den Zusatznutzen.




























1 Kommentar
Theorie und Praxis
von Karola Neuhaus am 03.02.2021 um 15:54 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.