
- DAZ.online
- News
- Pharmazie
- Biontech/Pfizer erhalten ...
FDA lässt BNT162b2 zu
Biontech/Pfizer erhalten Notfallzulassung für ersten COVID-19-Impfstoff in den USA
Stuttgart - 14.12.2020, 07:00 Uhr
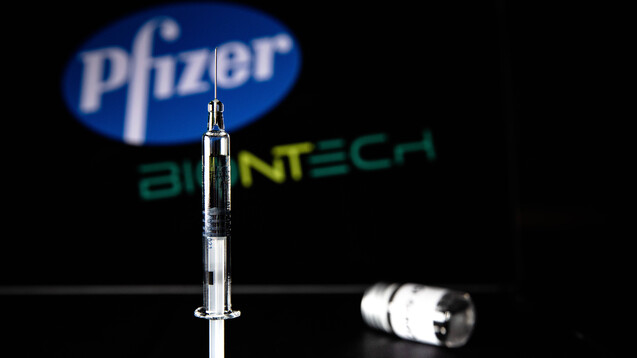
Ab sofort darf auch in den Vereinigten Staaten mit der Biotech/Pfizer-Vakzine BNT162b2 gegen Corona geimpft werden. (Foto: imago images / IP3press)
Nach Großbritannien, Kanada, Bahrain, Saudi-Arabien und Mexiko dürfen nun auch die Vereinigten Staaten mit BNT162b2 gegen COVID-19 impfen. Die FDA erteilte dem Biontech/Pfizer-Corona-Impfstoff am 11. Dezember die Emergency Use Authorization. Die EMA will bis 29. Dezember über die Zulassung des ersten Corona-Impfstoffs in der EU entscheiden.
Bereits am 2. Dezember überraschte Großbritannien mit der Notfallzulassung von BNT162b2. Großbritannien war weltweit das erste Land, in dem der Corona-Impfstoff von Biontech/Pfizer zugelassen wurde, zudem ist BNT162b2 der erste mRNA-Impfstoff, der diese Hürde nimmt. Nur wenige Tage später, am 9. Dezember, informierte auch Health Canada, dass sie die Bionech/Pfizer-Vakzine für wirksam und unbedenklich halten und im Rahmen einer EUA (Emergency Use Authorization) zugelassen haben. Zu dieser Einschätzung ist am 11. Dezember 2020 auch die US-amerikanische Arzneimittelbehörde gekommen und erteilte BNT162b2 die Notfallzulassung. Die Vereinigten Staaten sind damit das sechste Land, das seine Bürger:innen mit BNT162b2 gegen COVID-19 impfen kann.
Mehr zum Thema
Corona-Impfstoff BNT162b2
Biontech/Pfizer erhalten Impfstoff-Zulassung in Großbritannien

Corona-Impfstoff BNT162b2
Biontech/Pfizer beantragen Zulassung in der EU
Die Entscheidung war erwartbar. Schon vor Tagen äußerte sich die FDA positiv zu den von Biontech/Pfizer eingereichten Zulassungsunterlagen für BNT162b2, das Impfstoff-Beratungsgremium der FDA empfahl am 10. Dezember die Notfallzulassung (EUA, Emergency Use Authorization) des COVID-19-Impfstoffes (17 Gremiumsmitglieder hatten dafür gestimmt, vier dagegen). Auch die EMA prüft derzeit die Zulassung des COVID-19-Impfstoffs aus der Zusammenarbeit von Biontech/Pfizer. Se will sich bis spätestens 29. Dezember entschieden haben, äußerte sich jedoch auch bereits optimistisch.
Mehr Nebenwirkungen nach der zweiten Dosis
Grundlage für die EUA waren Studiendaten zur Sicherheit von BNT162b2 von 37.586 Teilnehmern in einer laufenden, randomisierten und placebokontrollierten Studie. Der FDA zufolge waren die meisten Probanden aus den Vereinigten Staaten: 18.801 erhielten den Impfstoff und 18.785 ein Kochsalz-Placebo, verabreicht wurden zwei Dosen jeweils im Abstand von drei Wochen. Die Teilnehmer wurden im Median zwei Monate nach Erhalt der zweiten Dosis nachbeobachtet. Zu den häufigsten Nebenwirkungen zählten Schmerzen an der Injektionsstelle, Müdigkeit, Kopfschmerzen, Muskelschmerzen, Schüttelfrost, Gelenkschmerzen und Fieber. Nach Angaben der FDA dauerten die Beschwerden typischerweise mehrere Tage an. Zudem beobachtete die FDA, dass die zweite Dosis tendenziell schlechter vertragen wurde als die erste: Nebenwirkungen seien häufiger aufgetreten.
95 Prozent Wirksamkeit
Den Nachweis der Wirksamkeit stützt die FDA auf Analyse von 36.523 Teilnehmern, die bis sieben Tage nach der zweiten Dosis keine Anzeichen einer SARS-CoV-2-Infektion aufwiesen. Von diesen Teilnehmern erhielten 18.198 den Impfstoff und 18.325 ein Placebo. Die FDA bestätigt die jüngst von Biontech/Pfizer ausgelobte Impfwirksamkeit von BNT162b2 zum Schutz vor COVID-19: Von insgesamt 170 COVID-19-Fällen traten 8 (ein schwerer Fall) in der BNT162b2-Gruppe auf, in der Placebogruppe erkrankten 162 (drei schwere Fälle). Allerdings: Wie lange der Impfschutz anhält und ob die BNT162b2 sodann auch die Übertragung von SARS-CoV-2 von Mensch zu Mensch verhindert, dazu gebe es bislang keine Daten.
mRNA-Impfstoff kann nicht ins menschliche Genom integriert werden
BNT162b2 ist ein mRNA-Impfstoff. Die enthaltene modifizierte mRNA codiert für das Spikeprotein auf der Oberfläche von SARS-CoV-2. Eingebettet in Lipidnanopartikel wird die mRNA nach Impfung an den Ribosomen der Zellen in Protein translatiert, und der Körper stellt damit sein Antigen selbst her. Es induziert die Bildung von neutralisierenden Antikörpern, stimuliert das zelluläre Immunsystem und soll dadurch vor COVID-19 schützen. Ein Einbau der Erbinformation des Spikeproteins in menschliches Genom ist nach Auskunft des Paul-Ehrlich-Instituts nicht möglich, da es sich einmal um RNA und das andere Mal um DNA handelt. „Beim Menschen befindet sich das Genom in Form von DNA im Zellkern. Eine Integration von RNA in DNA ist unter anderem aufgrund der unterschiedlichen chemischen Struktur nicht möglich. Es gibt auch keinen Hinweis darauf, dass die von den Körperzellen nach der Impfung aufgenommen mRNA in DNA umgeschrieben wird“, erklärt das PEI.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.