
- DAZ.online
- News
- Pharmazie
- PRAC überprüft COVID-19...
Wegen akuter Nierentoxizität
PRAC überprüft COVID-19-Arzneimittel Remdesivir
Stuttgart - 05.10.2020, 14:15 Uhr
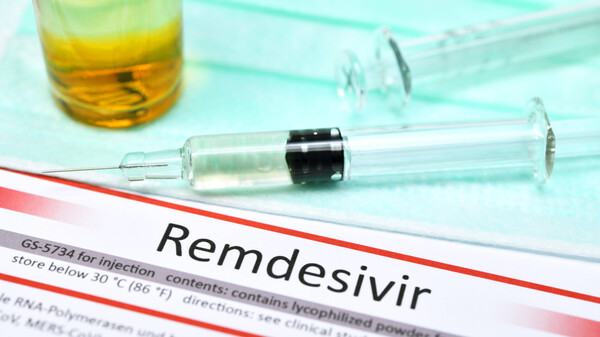
Der PRAC untersucht, ob Remdesivir möglicherweise die Nieren akut schädigt. Veklury ist das bislang erste und einzige Arzneimittel, das bei COVID-19 die Zulassung erhielt. (s / Foto: Crystal light / stock.adobe.com)
Der Sicherheitsausschuss der EMA (PRAC) hat ein Sicherheits-Review zum ersten zugelassenen Corona-Arzneimittel Remdesivir in Veklury eingeleitet. Der Grund: Den PRAC erreichte ein Signal zu akuter Nierenschädigung bei Patienten, die Remdesivir erhielten. Allerdings kann auch SARS-CoV-2 die Nieren schädigen. Was steckt hinter der Nierentoxizität – Remdesivir oder SARS-CoV-2? Dem geht der PRAC nun nach.
Veklury hat seit 3. Juli 2020 eine „bedingte Marktzulassung“ in der EU. Zugelassen ist es für die Behandlung von COVID-19 bei Erwachsenen und Jugendlichen ab zwölf Jahren mit Lungenentzündung und zusätzlichem Sauerstoffbedarf. Die bislang verfügbaren Daten zeigten, dass für diese schwerkranken Patienten der Nutzen des RNA-Polymerase-Inhibitors gegenüber den Risiken der Behandlung mit dem Virostatikum überwiegt. Allerdings erfolgte die Zulassung in einem beschleunigten Verfahren (Rolling-Review) bei dem der Humanarzneimittelausschuss (CHMP) noch während der klinischen Prüfung des Arzneimittels mit der Bewertung der jeweils verfügbaren Daten beginnt. Das bedeutet nun, dass in der Phase nach der Zulassung weiter Daten zur Sicherheit und Wirksamkeit von Remdesivir vorgelegt werden müssen.
Die EMA prüft alle neuen Informationen, die in monatlichen Sicherheitsberichten, regelmäßig aktualisierten Unbedenklichkeitsberichten (PSUR, Periodic Safety Update Report) und Signalmeldungen verfügbar werden.
Mehr zum Thema

Erstes COVID-19-Arzneimittel
Remdesivir erhält Zulassung in Europa

AkdÄ-Chef warnt
Keine vorschnelle Remdesivir-Zulassung
Der PRAC hat nun am 2. Oktober 2020 ein Sicherheits-Review zu Remdesivir eingeleitet. Der Pharmakovigilanzausschuss hat diese Überprüfung auf Grundlage von Meldungen zu Remdesivir in EudraVigilance initiiert. Wie die EMA mitteilt, liege ein „Sicherheitssignal“, sprich ein neues oder unvollständig dokumentiertes unerwünschtes Ereignis, das möglicherweise in Zusammenhang mit einer Arzneimittelanwendung steht, zu Remdesivir vor. Dem PRAC zufolge gibt es Berichte zu Patienten, bei denen unter Remdesivir akute Nierenschäden auftraten. Doch betont der PRAC: „Zum gegenwärtigen Zeitpunkt ist noch nicht geklärt, ob ein kausaler Zusammenhang zwischen Veklury und den Berichten über akute Nierenschädigungen besteht.“
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.