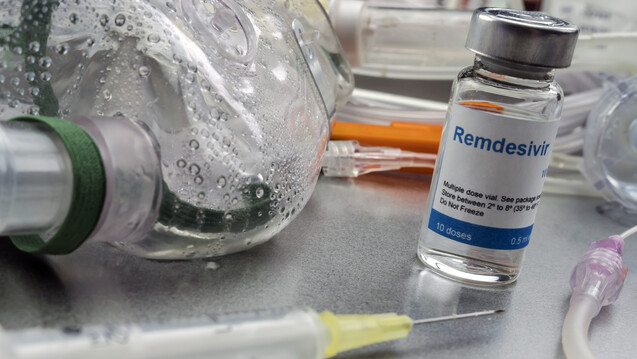
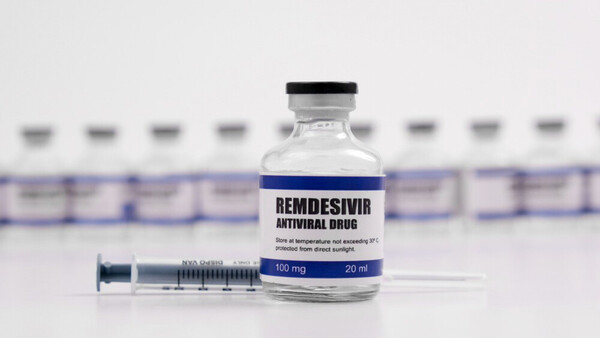
Compassionate Use – was ist das?
Die Europäische Arzneimittel-Agentur definiert „Compassionate Use“ wie folgt: „Compassionate Use“ ist eine Behandlungsoption, die die Verwendung eines nicht zugelassenen Arzneimittels ermöglicht. Unter bestimmten Voraussetzungen können in der Entwicklung befindliche Arzneimittel Gruppen von Patienten, die an einer Krankheit leiden, für die es keine befriedigenden zugelassenen Therapien gibt und die nicht in klinische Studien eintreten können, verfügbar gemacht werden. (…) Diese Programme werden nur dann eingeführt, wenn von dem Medikament erwartet wird, dass es Patienten mit lebensbedrohlichen, langwierigen oder zu schwerer Invalidität führenden Krankheiten hilft, die mit keinem derzeit zugelassenen Medikament zufriedenstellend behandelt werden können.“






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.