
- DAZ.online
- News
- Pharmazie
- Nach Härtefallprogrammen...
Gegen COVID-19
Nach Härtefallprogrammen jetzt klinische Studie mit Opaganib
Remagen - 14.05.2020, 11:30 Uhr
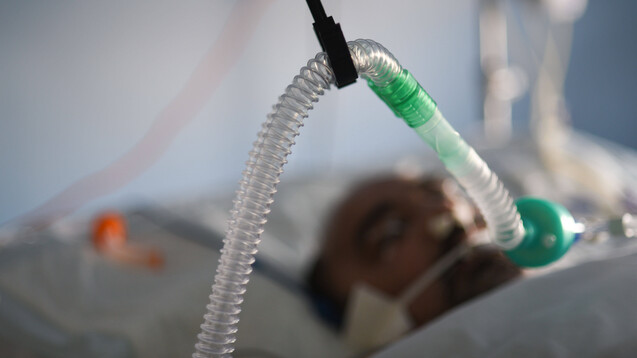
In die geplante Studie mit Opaganib sollen bis zu 40 stationäre Patienten aufgenommen werden, die an einer mäßigen bis schweren SARS-CoV-2-Infektion und einer Lungenentzündung leiden und zusätzlichen Sauerstoff benötigen. (m / Foto: imago / Hans Lucas)
Für die Behandlung von Patienten mit COVID-19 macht ein neuer Kandidat auf sich aufmerksam: Der selektive Sphingosinkinase-2 (SK2)-Inhibitor Opaganib soll sich jetzt in einer Phase-IIa-Studie beweisen.
Der selektive Sphingosinkinase-2 (SK2)-Inhibitor Opaganib von RedHill Biopharma hat die nächste Stufe der klinischen Erprobung gegen COVID-19 erklommen. Wie das Unternehmen mitteilt, hat die US-amerikanische Aufsichtsbehörde FDA die Genehmigung für eine klinische Studie Phase-IIa-Studie erteilt. In diese sollen bis zu 40 stationäre Patienten aufgenommen werden, die an einer mäßigen bis schweren SARS-CoV-2-Infektion und einer Lungenentzündung leiden und zusätzlichen Sauerstoff benötigen.
So wirkt Opaganib
Opaganib ist ein neuer „first-in-class“, oral verabreichter, selektiver Sphingosinkinase-2 (SK2)-Inhibitor. Durch die Hemmung von SK2 blockiert Opaganib die Synthese von Sphingosin-1-Phosphat (S1P), ein Lipid-Signalmolekül, das das Krebswachstum und Entzündungen fördert. Präklinische Daten sollen aber auch antivirale Aktivitäten gezeigt haben. Diese gründen sich darauf, dass die selektive SK2 auch im Replikations-Transkriptions-Komplex von positiv-strängigen ssRNA-Viren, ähnlich dem Coronavirus, eine Rolle spielt. Ihre Blockade könnte deshalb neben der antientzündlichen Wirkung auch die virale Replikation hemmen, so die Rationale für den Einsatz gegen COVID-19.
Opaganib hat nach Unternehmensangaben bereits erfolgreich mehrere präklinische Studien mit Onkologie-, Entzündungs-, Verdauungstrakt- und Strahlenschutz-Modellen sowie eine klinische Phase-I-Studie mit Krebspatienten mit soliden Tumoren im fortgeschrittenen Stadium durchlaufen. Es wird derzeit in einer Phase-I/IIa-Studie bei fortgeschrittenem Gallengangskarzinom und einer Phase-II-Studie bei Prostatakrebs untersucht. Nun soll sich Opaganib auch gegen COVID-19 beweisen.
Starke wissenschaftliche Grundlage
„Es besteht eine starke wissenschaftliche Grundlage für die potenzielle Wirksamkeit von Opaganib bei der Behandlung von COVID-19“, glaubt Mark L. Levitt, Medical Director bei RedHill. „Präklinische Daten zeigen, dass Opaganib die virale Replikation hemmen sowie die IL-6- und TNF-alpha-Spiegel, wichtige Entzündungsmediatoren, die bei COVID-19-Patienten mit mäßigem bis schwerem Krankheitsverlauf erhöht sind, senken kann.“
Die vorläufigen Daten aus dem Härtefallprogramm in Israel mit sechs behandelten Patienten bezeichnet Levitt als „ermutigend“. Opaganib habe sich als gut verträglich erwiesen und sowohl mit als auch ohne Behandlung mit Hydroxychloroquin eine klinische Verbesserung hervorgerufen. Erst vor Kurzem hatte RedHill mitgeteilt, dass Opaganib im Rahmen der Härtefallregelung auch in drei großen Krankenhäusern in Norditalien an etwa 160 lebensbedrohlich an COVID-19 erkrankten Patienten erprobt wird. In laufenden und abgeschlossenen klinischen Studien der Phase I und II für onkologische Indikationen, in pharmakokinetischen Studien an gesunden Freiwilligen sowie im Rahmen von Härtefallanfragen soll die Sicherheit und Verträglichkeit des Präparats für den Menschen bereits gezeigt worden sein.
Senkung des zusätzlichen Sauerstoffbedarfs als primärer Zielparameter
In die randomisierte, doppelblinde, placebokontrollierte Phase-IIa-Studie sollen bis zu 40 Patienten aufgenommen werden, die an einer mäßigen bis schweren SARS-CoV-2-Infektion und einer Lungenentzündung erkrankt sind, aufgrund dessen im Krankenhaus behandelt werden und zusätzlichen Sauerstoff benötigen. Das Unternehmen geht davon aus, dass die Rekrutierung der Teilnehmer umgehend gestartet werden kann. Die Patienten werden 1:1 randomisiert und erhalten zusätzlich zu Standardtherapien entweder Opaganib oder Placebo. Primärer Zielparameter der Studie ist die Senkung des Gesamtbedarfs an zusätzlichem Sauerstoff im Verlauf der Behandlung über einen Zeitraum von bis zu 14 Tagen. Als sekundäre Endpunkte nennt das Unternehmen die Dauer bis zur fünfzigprozentigen Reduktion des Sauerstoffbedarfs sowie den Anteil fieberfreier Patienten und den Anteil an Patienten mit negativen Nasenabstrichen an Tag 14.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.