
- DAZ.online
- News
- Pharmazie
- EMA prüft Remdesivir
Nach Notfallzulassung in den USA
EMA prüft Remdesivir
Stuttgart - 04.05.2020, 17:50 Uhr
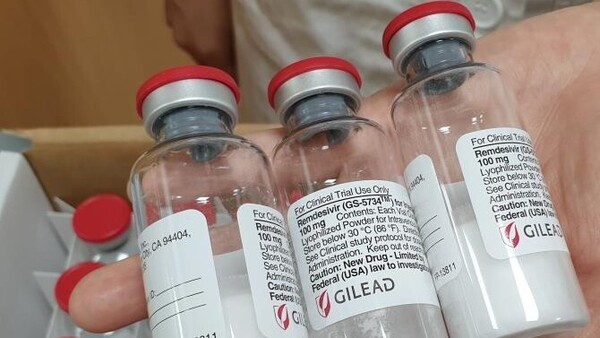
Am 1. Mai 2020 ließ die FDA das Virostatikum Remdesivir bei COVID-19 im Rahmen einer Notfallgenehmigung (Emergency Use Authorization, EUA) zu. Auch die EMA prüft Remdesivir bei SARS-CoV-2. (ch/Foto: imago images / Fotoarena)
Wann kommt Remdesivir in der EU?
Die Ergebnisse der ACTT-Studie sind zum aktuellen Zeitpunkt nicht ausgewertet, es sei somit zu früh, um Schlussfolgerungen hinsichtlich des Nutzen-Risiko-Verhältnisses des Medikaments bei Patienten mit COVID-19 zu ziehen. Der CHMP will alle neuen Daten, die während des Remdesivir-Reviews verfügbar werden, in seine Bewertung einfließen lassen, einschließlich einer vor kurzem im Fachjournal Lancet veröffentlichten Studie aus China. Entgegen der ACTT-Zwischenanalyse aus den Vereinigten Staaten, verkürzte Remdesivir in der chinesischen Untersuchung weder die Krankheitsdauer, noch senkte es die Mortalität.
Obwohl der Gesamtzeitplan für die Überprüfung von Remedesivir zum jetzigen Zeitpunkt nicht vorhersehbar ist, erwartet der CHMP, dass das Rolling-Review-Verfahren es der EMA ermöglichen wird, ihre Bewertung im Vergleich zu einem regulären Zulassungsverfahren deutlich früher abzuschließen und dennoch gleichzeitig sicherzustellen, dass ein fundiertes wissenschaftliches Gutachten erstellt wird.
Remdesivir als Compassionate Use in der EU
Obwohl Remedesivir in der Europäischen Union noch nicht zugelassen ist, ist es für Patienten dennoch über klinische Studien und sogenannte Compassionate-Use-Programme, über die Patienten Zugang zu nicht zugelassene Arzneimittel in Notfallsituationen erhalten, verfügbar. Auch in Deutschland wird Remdesivir in Härtefallprogrammen untersucht.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.