
- DAZ.online
- News
- Pharmazie
- EMA prüft Remdesivir
Nach Notfallzulassung in den USA
EMA prüft Remdesivir
Stuttgart - 04.05.2020, 17:50 Uhr
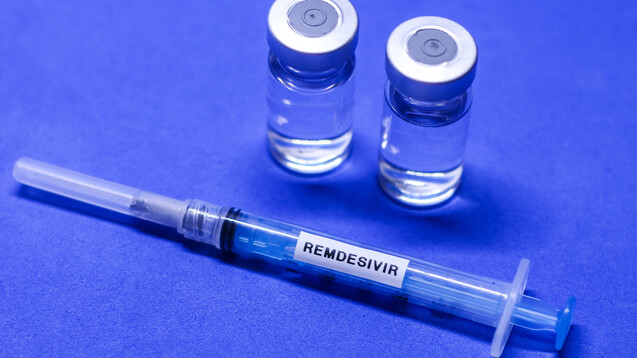
Am 1. Mai 2020 ließ die FDA das Virostatikum Remdesivir bei COVID-19 im Rahmen einer Notfallgenehmigung (Emergency Use Authorization, EUA) zu. Auch die EMA prüft Remdesivir bei SARS-CoV-2. (ch/Foto: imago images / Fotoarena)
Rolling Review für Remdesivir
Auch die Europäische Arzneimittel-Agentur EMA prüft das Virostatikum: Der Ausschuss für Humanarzneimittel (CHMP) der EMA hat ein Rolling Review, eine gleitende Überprüfung, von Remdesivir zur Behandlung von COVID-19 eingeleitet. Das Rolling-Review-Verfahren ist ein Regulierungsinstrument, das die EMA nutzen kann, um ein vielversprechendes Arzneimittel während eines Notfalls im Bereich der öffentlichen Gesundheit, wie beispielsweise der laufenden Pandemie, zu bewerten. Normalerweise müssen alle zulassungsrelevanten Arzneimitteldaten zu Beginn des Evaluationsverfahrens eingereicht werden. Im Falle einer gleitenden Überprüfung werden die CHMP-Berichterstatter ernannt, während die Entwicklung noch im Gange ist, und die Agentur überprüft die Daten, sobald sie verfügbar sind.
ACTT-Studie: Remdesivir verkürzte Krankheitsdauer
„Der Beginn der fortlaufenden Überprüfung von Remdesivir bedeutet lediglich, dass die Bewertung von Remdesivir begonnen hat und nicht, dass die Vorteile die Risiken überwiegen“, betont die EMA. Die Entscheidung des CHMP vom 30. April 2020, Remdesivir in einem Rolling Review fortlaufend zu prüfen, basiert der EMA zufolge auf vorläufigen Ergebnissen der ACTT-Studie (Adaptive COVID-19 Treatment Trial), der ersten klinischen Studie in den Vereinigten Staaten zu Remdesivir. Durchgeführt und gesponsert wird ACTT vom National Institute of Allergy and Infectious Diseases (NIAID), das Teil des Nationalen Gesundheitsinstituts NIH (National Institute of Health) ist. Die ACTT Studie war auch Grundlage der Notfallgenehmigung bei der FDA. Laut ACTT zeigten Patienten, die Remdesivir erhielten, eine 31 Prozent kürzere Genesungszeit als Patienten unter Placebo: Im Median waren Remdesivir-Patienten nach elf Tagen, Placebo-Patienten nach 15 Tagen genesen. Die Ergebnisse deuteten dem NIH zufolge auch auf einen Überlebensvorteil hin: Die Mortalitätsrate in der Remdesivir-Gruppe lag bei 8 Prozent, in der Placebogruppe bei 11,6 Prozent.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.