
- DAZ.online
- News
- Pharmazie
- EMA prüft Remdesivir
Nach Notfallzulassung in den USA
EMA prüft Remdesivir
Stuttgart - 04.05.2020, 17:50 Uhr
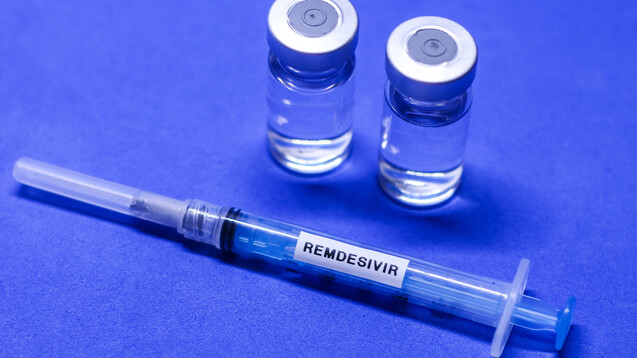
Am 1. Mai 2020 ließ die FDA das Virostatikum Remdesivir bei COVID-19 im Rahmen einer Notfallgenehmigung (Emergency Use Authorization, EUA) zu. Auch die EMA prüft Remdesivir bei SARS-CoV-2. (ch/Foto: imago images / Fotoarena)
Remdesivir ist zugelassen – bislang nur durch die FDA in den Vereinigten Staaten und nur in Form einer Notfallgenehmigung, die keiner formellen Zulassung entspricht. Das Virostatikum soll laut einer Studie in den USA die Krankheitsdauer bei COVID-19 verkürzen, es darf nur bei schwerem SARS-CoV-2-Infektionsverlauf eingesetzt werden, dann aber sowohl bei Erwachsenen als auch bei Kindern. Die EMA prüft Remdesivir ebenfalls.
Die FDA hat am 1. Mai 2020 Remdesivir die Notfallgenehmigung erteilt. Das Virostatikum darf in den Vereinigen Staaten künftig bei Erwachsenen und Kindern zur Behandlung von vermutetem oder laborbestätigtem COVID-19 eingesetzt werden, wenn diese mit einer schweren Erkrankung – definiert als SpO2 ≤ 94 Prozent (an Raumluft) und zusätzlichem Sauerstoffbedarf, erforderlicher mechanischer Beatmung oder extrakorporaler Membranoxygenierung (ECMO) – ins Krankenhaus eingeliefert werden. Die Anwendung von Remdesivir ist folglich auf ein stationäres Setting begrenzt. Die USA sind das erste Land, das nun – wenn auch nur per Ausnahmegenehmigung (Emergency Use Authorization, EUA) – ein gegen COVID-19 zugelassenes Arzneimittel hat.
Mehr zu Remdesivir bei COVID-19
Beschleunigte Zulassung bei der FDA?
Widersprüchliches zu Remdesivir – hilft es bei COVID-19?

Remdesivir bei Covid-19
Arzneimittel gegen das Coronavirus SARS-CoV-2: Studien starten
Die Genehmigung für den Einsatz von Remdesivir in Notfällen entspricht keiner gewöhnlichen Zulassung, das wäre ein deutlich aufwendigerer Prozess gewesen. Zurzeit gibt es nur wenige klinische Daten zu Remdesivir bei COVID-19 beim Menschen, nicht alle Untersuchungen haben einen Nutzen des Virostatikums bestätigt.
COVID-19 lebensbedrohlich und ohne zugelassene Therapie
In einem Brief an den Hersteller Gilead erklärt Denise M. Hinton, Chief Scientist bei der FDA, das rasche Inverkehrbringen von Remdesivir sei möglich, da SARS-CoV-2 eine ernste oder lebensbedrohliche Erkrankung hervorrufen könne. Es sei die Annahme vertretbar, dass Remdesivir wirksam bei COVID-19 ist und der mögliche Nutzen die potenziellen Risiken überwiegt, auch weil es keine zugelassene und verfügbare Alternative zu Remdesivir gibt.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.