
- DAZ.online
- News
- Politik
- BMG: Ärzte müssen ...
Nachfragen zu Cytotec
BMG: Ärzte müssen Nebenwirkungen melden – auch beim Off-Label-Use
Stuttgart - 28.02.2020, 13:45 Uhr

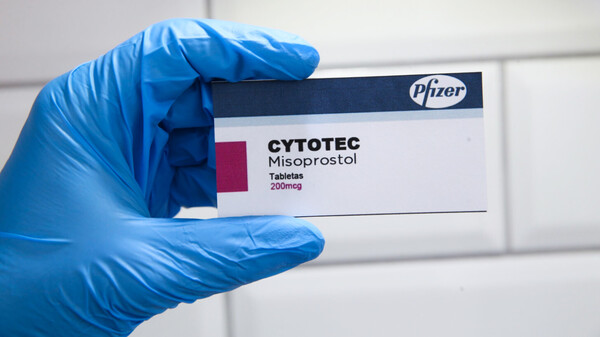
In deutschen Kreißsälen wird einem SZ-Bericht zufolge häufig Cytotec zur Einleitung der Geburt angewendet. Zugelassen ist es dafür nicht, trotzdem müssen Ärzte Nebenwirkungen melden. (c / Foto: Robert/stock.adobe.com)
Einem Bericht der „Süddeutschen Zeitung“ zufolge wird in der Geburtshilfe mit Cytotec flächendeckend ein in Deutschland nicht zugelassenes Arzneimittel eingesetzt, um Geburten einzuleiten. Deutlich weniger flächendeckend scheinen demnach die Meldungen über unerwünschte Wirkungen, die es laut SZ in erheblichem Ausmaß gibt, an die zuständigen Behörden zu sein. Die Bundestagsabgeordneten Sylvia Gabelmann (Die Linke) und Katrin Helling-Plahr (FDP) haben sich nun diesbezüglich bei der Bundesregierung erkundigt.
„Cytotec® ist in Deutschland nicht zugelassen, um Geburten einzuleiten. Trotzdem wird die Pille täglich genau dafür eingesetzt“, titelte vor etwas mehr als zwei Wochen die Süddeutsche Zeitung (SZ). Denn das zur Ulkusprophylaxe zugelassene und nach wie vor in anderen europäischen Ländern vertriebene Präparat sei ungleich preiswerter als die zur Weheneinleitung zugelassenen Alternativen, weshalb die Kliniken aus Kostengründen darauf zurückgreifen würden, obwohl die Datenlage schlecht sei, so die SZ. Das Problem dabei sei allerdings, dass es unter dem Medikament zu einer nicht mehr zu kontrollierenden Wehentätigkeit (Wehensturm) kommen kann, in deren Folge die Gebärmutter reißen und die Sauerstoffversorgung des Kindes stark eingeschränkt werden kann. Das könne zu Gehirnschäden beim Kind bis hin zum Tod bei Mutter und/oder Kind führen, hieß es. Angesichts der Berichterstattung entstand der Eindruck, dass deutsche Behörden ahnungslos und Ärzte leichtsinnig mit der Problematik umgehen. Verschiedene Fachgesellschaften wie die Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) haben sich entsprechend irritiert darüber gezeigt. Zudem erweckte der SZ-Bericht den Eindruck, dass es generell eine Überwachungslücke bei Nebenwirkungen von Arzneimitteln gebe. Besonders beim Off-Label-Use bestehe die Gefahr, dass Ärzte noch seltener Nebenwirkungen melden würden, als sie es ohnehin tun weil sie bzw. die Klinik persönlich haftbar gemacht werden könnten, so der Tenor.
Mehr zum Thema

Rote-Hand-Brief
Warnung vor erhöhter Wehenfrequenz nach Misoprostolgabe

Misoprostol in Cytotec – Teil 1
Gefährlich oder Lebensretter für Frauen?
Gibt es eine Lücke bei der Überwachung?
Nun hat sich die Bundestagsabgeordnete Sylvia Gabelmann (Die Linke) bei der Bundesregierung zu dem Thema erkundigt. Sie wollte wissen, welche Maßnahmen ergriffen wurden, um die Risiken bei der Off-Label-Verwendung des Magenschutzmittels Cytotec® im Rahmen der Geburtseinleitung zu erfassen. Außerdem fragt Gabelmann, inwiefern hier tatsächlich eine Lücke bei der Überwachung besteht, die vor allem dadurch bedingt sein soll, dass nur die Hersteller, aber nicht die Ärzte gesetzlich verpflichtet sind, Nebenwirkungen von Arzneimitteln zu melden.
Letzterer Aussage widerspricht das Bundesgesundheitsministerium (BMG) in seiner Antwort entschieden. Ärzte seien berufsrechtlich verpflichtet – auch im Rahmen des Off-Label-Use –, ihnen bekannt gewordene unerwünschte Arzneimittelwirkungen an die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu melden, heißt es. Von dort werde diese Information dann an die zuständigen Behörden weitergeleitet, die die Fälle prüfen und gegebenenfalls Maßnahmen einleiten. Der Tatsache, dass im Rahmen des Off-Label-Use bei Schäden eine Haftung der behandelnden Ärzte und – bei stationärer Behandlung – des Krankenhauses besteht sowie der damit verbundenen besonderen Verantwortung, müssten sich die Behandler bewusst sein – so wie in vielen anderen ärztlichen Entscheidungssituationen auch, so das BMG weiter.
Wie wird die Umsetzung der Meldepflicht gewährleistet?
Was die Maßnahmen zur Erfassung der Risiken betrifft, verweist das BMG auf die periodischen Sicherheitsberichte (Periodic Safety Update Report, PSUR) auf europäischer Ebene. In deren Rahmen bewerte der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) bei der Europäischen Arzneimittel-Agentur (EMA) Änderungen beim Nutzen-Risiko-Verhältnis. Dabei werde auch der Off-Label-Use von Cytotec® in der Geburtshilfe regelmäßig betrachtet. Als Beispiel, dass die Betrachtung Konsequenzen haben kann, führt das BMG an: So sei als Folge eines PSUR-Bewertungsverfahrens die Fach- und Gebrauchsinformation von Cytotec® unter anderem dahingehend geändert worden, dass beim geburtshilflichen Off-Label-Use Präzisierungen zu dem Risiko einer Uterusruptur vorgenommen wurden.
Mehr zum Thema

Misoprostol in Cytotec – Teil 2
Geburtseinleitung nach Leitlinie – nicht möglich?
Misoprostol in Cytotec – Teil 3
Ein pharmazeutischer Blick auf den Fall Cytotec
Auch die FDP-Gesundheitspolitikerin Katrin Helling-Plahr hat sich zum Thema Cytotec® bei der Bundesregierung erkundigt. Sie wollte wissen, ob sichergestellt ist, dass Todesfälle und Geburts- oder Folgeschäden nach Verwendung wehenauslösender Medikamente im Rahmen des Off-Label-Use in jedem Fall von der medizinischen Einrichtung an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder Paul-Ehrlich-Institut (PEI) gemeldet werden. Auch hier verweist das BMG auf das Berufsrecht, das Ärzte, nicht jedoch Einrichtungen, zur Meldung von unerwünschten Arzneimittelwirkungen an die Arzneimittelkommission der deutschen Ärzteschaft verpflichte – auch beim Off-Label-Use. Voraussetzung für diese berufsrechtlich verankerte Meldepflicht sei, dass der Arzt den Verdacht hat, dass zumindest die Möglichkeit eines kausalen Zusammenhangs zwischen dem Ereignis und der Anwendung des Arzneimittels besteht. Zu etwaigen Maßnahmen zur Umsetzung der Meldepflicht oder Sanktionen bei Missachtung äußert sich das BMG an dieser Stelle allerdings nicht.
74 Verdachtsmeldungen beim BfArM
Dem BfArM lagen bis Ende Oktober 2019 insgesamt 74 Verdachtsmeldungen unerwünschter Arzneimittelwirkungen im Zusammenhang mit Cytotec® bei der Geburtseinleitung vor. Darunter sei ein Todesfall: Ein Neugeborenes sei vier Tage nach der Geburt durch eine Lungenblutung gestorben. Die Mutter hatte Cytotec® und eine weiteres Präparat (Misodel®) zur Geburtseinleitung erhalten. Wie vollständig diese Meldungen sind, lässt sich natürlich nicht sagen.


























1 Kommentar
Theorie und Praxis von Cytotec
von Corina am 01.03.2020 um 8:48 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.