
- DAZ.online
- News
- Pharmazie
- Forscher beschreiben ...
Neue Ansätze für die Insulintherapie?
Forscher beschreiben Bindungsstelle 2 des Insulinrezeptors
Remagen - 29.11.2019, 16:30 Uhr
Wie und wo wirkt Insulin? Dazu haben Forscher kürzlich ein weiteres Puzzleteil analysieren können. (m / Foto: imago images / Jochen Tack)
Obwohl das Bauchspeicheldrüsenhormon Insulin bereits vor fast 100 Jahren entdeckt wurde, ist noch immer nicht vollkommen geklärt, wie es genau mit seinem Rezeptor interagiert. Mit einer neuen Studie haben Forscher jetzt ein weiteres Puzzleteil charakterisieren können. Sie hoffen, dass mit ihren Ergebnissen bessere therapeutische Insuline entwickelt werden können.
Das Hormon Insulin steuert sowohl den Stoffwechsel als auch das Wachstum. Neben dem Diabetes wird ihm auch eine Beteiligung an anderen chronischen Leiden, einschließlich neurodegenerativer Erkrankungen und Krebs zugeschrieben. Die biologischen Wirkungen von Insulin werden über die Bindung an Insulinrezeptoren auf der Zelloberfläche des Leber-, Muskel- und Fettgewebes vermittelt. Nach der Bindung an den Rezeptor löst das Hormon in der Zelle eine Signalkaskade aus.
Die Wirkung auf den Glucosestoffwechsel beruht auf mehreren Mechanismen. Zu den wichtigsten gehören Membraneffekte wie die Beschleunigung der Aufnahme von Glucose, Aminosäuren und Kalium in Muskel- und Fettzellen. Hinzu kommen metabolische Effekte. So wird die Synthese und Speicherung von Glykogen in Leber und Muskel induziert, die Triglyceridsynthese in Leber und Fettgewebe gefördert und die Gluconeogenese in der Leber sowie die Proteolyse und die Glykogenolyse gehemmt.
Suche nach Insulinen, die wirken wie das „natürliche“ Hormon
„Es ist nach wie vor eine Herausforderung, Insuline zu erzeugen, die das gesamte Spektrum der endogenen Insulinwirkung widerspiegeln“, erklärt Ünal Coskun, Forschungsgruppenleiter am Institut für Pankreatische Inselzellforschung (IPI) und Paul-Langerhans-Institut Dresden (PLID). „Der Hauptgrund dafür ist, dass wir immer noch nicht genug darüber wissen, wie Insulin an seinen Rezeptor bindet und wie dieses Signal innerhalb der Zelle weitergegeben wird.“
Der Lösung dieses Rätsels ist ein Forscherteam, dem Coskun angehört, jetzt ein Stück näher gekommen. Das Team besteht aus Wissenschaftlern vom Paul-Langerhans-Institut Dresden, einem Satelliten des Helmholtz-Zentrums München und Partner des Deutschen Zentrums für Diabetesforschung (DZD) und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden. Die Ergebnisse, die in Zusammenarbeit mit Kollegen des Max-Planck-Instituts für Biochemie in München, der McGill University in Kanada und der Universität Helsinki gewonnen wurden, sind im Journal of Cell Biology (JCB) nachzulesen.
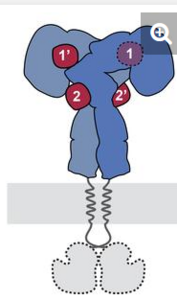
Bindungsstelle 2 im Fokus
Insulin binde vermutlich an zwei verschiedenen Stellen auf dem Rezeptor, erklären die Forscher. Über die Wechselwirkungen an Bindestelle 1 wisse man mittlerweile recht gut Bescheid, nicht aber über das, was an Bindungsstelle 2 passiere. Dies konnten die Wissenschaftler jetzt mit der neuen Studie zeigen. Sie nutzten hierfür die sogenannte Kryoelektronenmikroskopie, eine leistungsstarke Technik, die ein detailliertes 3D-Bild der Ektodomäne des Insulinrezeptors lieferte. Die Ektodomäne ist der Abschnitt eines Membranproteins, der in den Extrazellulärraum ragt. Parallel zu der Kryoelektronenmikroskopie verwendeten die Wissenschaftler für ihre Untersuchung computergestützte Modellierungs- und Simulationsmethoden, um die Wechselwirkungen auf atomarer Ebene zu verstehen.
Vom „U“ zum „T“
Mit diesen Verfahren gelang es den Forschern laut eigener Aussage erstmals, die Bindung von Insulin an der zweiten Bindungsstelle direkt zu beobachten und zu zeigen, wie der Insulinrezeptor seine Konformation zu einer T-förmigen Struktur verändert. Dass der Rezeptor nach Bindung von Insulin vom „U“ zum „T“ transformiert wird, hatte ein ähnlich zusammengesetzte Gruppe vom Paul-Langerhans-Instituts Dresden mit Kollegen der New Yorker Rockefeller University erst vor eineinhalb Jahren erstmals beschrieben.
Sie hatte gezeigt, dass der Rezeptor in Abwesenheit von Insulin die Gestalt eines umgekehrten „U” aufweist, wobei die Kinasedomänen an den beiden Enden voneinander getrennt sind. Bei der Bindung an den Rezeptor löst das Insulin eine umfassende Restrukturierung von der „U“ in eine „T-Form“ aus. Dabei kommen die Kinasaenden miteinander in Berührung, womit die Signalweitergabe in Gang gesetzt wird.
Zwei identische Teile mit jeweils zwei Insulinbindungsstellen
„Der Schlüssel lag darin, den äußeren Teil des Insulinrezeptors zu untersuchen, nachdem er mit hohen Insulinkonzentrationen gesättigt wurde“, erläutert die Mitautorin der Studie Theresia Gutmann vom Paul-Langerhans-Institut. Dafür hätten die Forscher mehr als 8.000 elektronenmikroskopische Bilder aufgenommen und mehr als 300.000 einzelne Rezeptorpartikel analysiert, fügt Co-Autor Ingmar Schäfer von der Abteilung Strukturzellbiologie am Max-Planck-Institut für Biochemie (MPIB) an. So konnten die Wissenschaftler erstmals die Struktur der gesamten dimeren Ektodomäne des Insulinrezeptors, gesättigt mit vier Insulin-Molekülen, darstellen. Nach ihrer Beschreibung besteht der Rezeptor aus zwei identischen Teilen, die jeweils zwei Insulinbindungsstellen enthalten.
Die Forscher hoffen nun, dass diese neuen Details zu den Interaktionen zwischen Insulin und seinem Rezeptor die bisherigen Modelle der Insulinbindung erweitern können. Sie könnten damit den Weg für neue Ansätze des strukturbasierten Wirkstoffdesigns ebnen.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.