Das Zollinger-Ellison-Syndrom
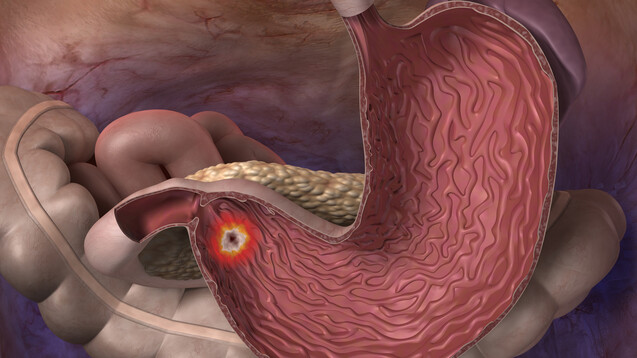
In der Leitlinie „Neuroendokrine Tumore“ (NET) wird auch auf das Zollinger-Ellison Syndrom eingegangen. Dort liest man, dass rund 5 bis 6 Prozent aller Magen-NET auf den Typ II entfallen, der mit einer multiplen endokrinen Neoplasie Typ 1 (MEN1) und einem Zollinger-Ellison-Syndrom (ZES) als Folge eines Gastrinoms assoziiert ist. Die bei dem Zollinger-Ellison-Syndrom zugrundeliegende Hypergastrinämie sei in der Regel verursacht durch lokoregionäre Lymphknoten- oder Lebermetastasen. Die biochemische Diagnose erfolge durch den Nachweis von erhöhten Gastrinspiegeln im Blut bei daraus resultierender verstärkter Magensäuresekretion (pH < 2).
Die exzessive Gastrin-Sekretion beim Gastrinom/Zollinger-Ellison-Syndrom führt der Leitlinie zufolge zu rezidivierenden Ulzerationen des Magens, Duodenums und Jejunums, sowie unbehandelt zu oberen gastrointestinalen Blutungen, Diarrhö, Steatorrhö und Refluxbeschwerden. Als Ziel der medikamentösen Therapie wird somit die Symptomkontrolle und die Verhinderung der genannten Komplikationen angegeben.

































0 Kommentare
Das Kommentieren ist aktuell nicht möglich.