
- DAZ.online
- News
- Apotheke
- Hexal: Weiterer Ranitidin...
Nitrosamin-Spuren in Fertigarzneimitteln
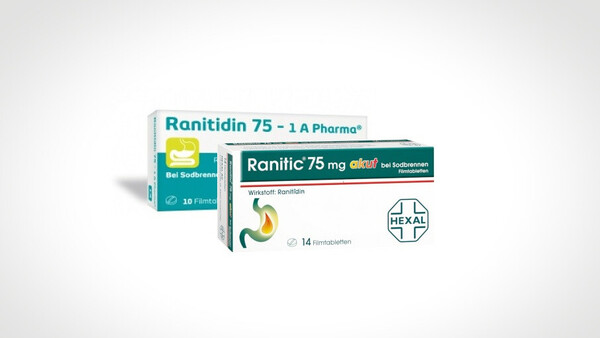
Hexal: Weiterer Ranitidin-Rückruf
Stuttgart - 17.10.2019, 13:59 Uhr

Die US-Arzneimittelbehörde FDA verweist mittlerweile auf eine Testmethode, die Hersteller zum Nachweis von NDMA in Ranitidin anwenden sollen. Diese Methode verhindere, anders als bei Valisure, den Abbau von Ranitidin während der Analyse und somit auch die NDMA-Bildung. ( r / Foto: Slavko Sereda / stock.adobe.com)
Wie die Arzneimittelkommission der Deutschen Apotheker (AMK) am heutigen Donnerstag informiert, wird Ranitic injekt von Hexal zurückgerufen. Interessant daran ist, dass nun auch Spuren der Nitrosaminverunreinigung NDMA in Fertigarzneimitteln und nicht nur im Wirkstoff selbst gefunden wurden.
Erst kürzlich berichtete DAZ.online darüber, dass noch nicht alle Präparate, die das Antazidum Ranitidin als Wirkstoff enthalten, vom deutschen Markt zurückgerufen wurden. Insgesamt erscheint die Rückrufsituation (auch weltweit) eher unübersichtlich. Laut der kanadischen Arzneimittelbehörde (Health Canada) deuten aktuelle Ergebnisse darauf hin, dass NDMA unabhängig vom Hersteller in Ranitidin enthalten sein kann. Der Vertrieb von Ranitidin wurde in Kanada deshalb vorerst komplett eingestellt. Allerdings kommt das keinem Rückruf gleich, sodass Ranitidin, das sich bereits in den Apotheken befindet, noch verkauft werden kann. Zusätzlich sind aber auch in Kanada herstellerbezogene Rückrufe erfolgt.
Mehr zum Thema

Valisure, FDA, EMA und Health Canada
NDMA in Ranitidin: Verunreinigt beim Hersteller oder vom Wirkstoff selbst?

die ersten Rückrufe
NDMA in Ranitidin von Betapharm, Hexal, 1 A Pharma, AbZ und Ratiopharm
In Deutschland verriet Anfang Oktober ein Blick auf die bisherige Rückrufliste der AMK und ein Blick in die Lauer-Taxe, dass (noch) nicht alle Ranitidin-Präparate zurückgerufen worden sind. Zumindest die Ranitidin-Präparate in der rezeptfreien Dosierung mit 75 mg scheinen aber alle gänzlich nicht mehr im Handel zu sein. Bislang gar nicht vom Rückruf betroffen scheinen die Aliud Pharma GmbH, die Axcount Generika GmbH und die Stadapharm GmbH zu sein.
Währenddessen wurde Ranitidin von Betapharm beispielsweise nur chargenbezogen zurückgerufen, bei Ranitidin von Hexal schien die Infusionslösung nicht betroffen zu sein – am heutigen Donnerstag wird nun aber auch letztere durch die Hexal AG zurückgerufen:
Ranitic® injekt 10 mg/ml
5x5 ml, Konzentrat zur Herstellung einer Injektions- oder Infusionslösung
Alle Chargen mit dem Verfalldatum bis einschließlich 10/2020
(PZN 07581514)
soll zur Gutschrift mittels APG-Formular über den pharmazeutischen Großhandel zurückgeschickt werden. Krankenhausapotheken werden um direkte Rücksendung an die Retourenabteilung der Salutas Pharma GmbH gebeten.
Spuren von NDMA auch in Fertigarzneimitteln gefunden
Erneut sei von keinem akuten Patientenrisiko auszugehen und der Rückruf erfolge aus Gründen des vorbeugenden Gesundheitsschutzes, heißt es in der AMK-Meldung. Allerdings verbirgt sich auch eine neue Information im Rückruf: „Im Zuge der weiteren Untersuchung von ranitidinhaltigen Arzneimitteln, wurden bei dem für das genannte Präparat eingesetzten Wirkstoff sowie in daraus hergestellten Fertigarzneimitteln Spuren von N-Nitrosodimethylamin (NDMA) gefunden.“
Bislang war – ob Betapharm, Hexal, 1 A Pharma, AbZ oder Ratiopharm – keine Rede von einer Verunreinigung der Fertigarzneimittel gewesen und man hatte überall in den Rückrufen denselben Wortlaut gelesen: „Es wurde festgestellt, dass der Wirkstoff Ranitidin-HCl bestimmter Wirkstoffhersteller verunreinigt ist. Bei der Verunreinigung handelt es sich um N-Nitrosodimethylamin (NDMA). Dieser Stoff ist von der Internationalen Agentur für Krebsforschung der WHO und der EU als potentiell krebserregend beim Menschen eingestuft.“
Mehr zum Thema

Dauerbrenner Nitrosamine
Kontaminiertes Ranitidin: Keine Überraschung
Eine Frage, die sich aus den weltweit uneinheitlichen Ranitidin-Rückrufen ergibt und weiterhin unbeantwortet bleibt, ist: Wurde der Wirkstoff Ranitidin beim Hersteller mit dem Nitrosamin NDMA verunreinigt oder stammt das NDMA vom Wirkstoff selbst – ist also eine inhärente Problematik des Ranitidins? Die US-Versandapotheke Valisure, mit angeschlossenem Labor war entscheidender Hinweisgeber im Fall und scheint sich in ihrem Fazit bereits sicherer als die Arzneimittelbehörden zu sein. Es könne zwar auch sehr gut ein Kontaminationsproblem bei Ranitidin vorliegen: „Allerdings sehen wir ein viel größeres Problem in der inhärenten Instabilität des Moleküls selbst und seiner Fähigkeit, im menschlichen Körper sehr hohe Mengen NDMA bilden zu können“, schrieb ein Sprecher der US-Online-Apotheke Valisure Ende September an DAZ.online.

Sechs Monate Zeit
EMA fordert: Alle chemischen Wirkstoffe auf Nitrosamine prüfen!
Die EMA teilte auf Nachfrage von DAZ.online Anfang Oktober mit, dass sie sich ebenso mit der Bildung von NDMA im Körper beschäftigt. Die Prüfung des Falls Ranitidin kann online auf den Seiten der EMA mitverfolgt werden. Dort findet sich nicht nur der Zeitplan für das Verfahren – in dem zum Dezember 2019 eine Empfehlung durch den Humanarzneimittelausschuss der EMA erwartet wird (CHMP) –, sondern auch eine Liste der Fragen, die die Unternehmen bis zum 24. Oktober beantworten sollen. Darin finden sich auch Fragen zu den „In-vivo-Aspekten“.
Seit Ende September: Alle chemischen Wirkstoffe müssen auf Nitrosamine geprüft werden
Der Humanarzneimittelausschuss der EMA (CHMP) hat mittlerweile (am 26. September) allgemeine Leitlinien zur Vermeidung von Nitrosamin-Verunreinigungen in Humanarzneimitteln, die chemisch synthetisierte Wirkstoffe enthalten, veröffentlicht. Es soll zudem geprüft werden, ob in Zukunft auch für nicht chemisch synthetisierte Arzneimittel entsprechende Leitlinien erstellt werden.
Alle Marktzulassungsinhaber für Humanarzneimittel, die chemisch synthetisierte Wirkstoffe enthalten, müssen ihre Arzneimittel seit dem 26.09.2019 „vorsorglich“ auf das mögliche Vorhandensein von Nitrosaminen prüfen. Nach einer solchen Risikobewertung durch die Unternehmen sollen diese dann alle Produkte, die im Ergebnis als gefährdet gelten, auch analytisch testen. Die Risikobewertung soll spätestens in den nächsten sechs Monaten abgeschlossen sein. Welche Grenzwerte toleriert werden sollen, werde derzeit noch geprüft – angesichts der beträchtlichen Zahl an Wirkstoffen und Fertigarzneimitteln.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.