
- DAZ.online
- News
- Apotheke
- Hexal: Weiterer Ranitidin...
Nitrosamin-Spuren in Fertigarzneimitteln
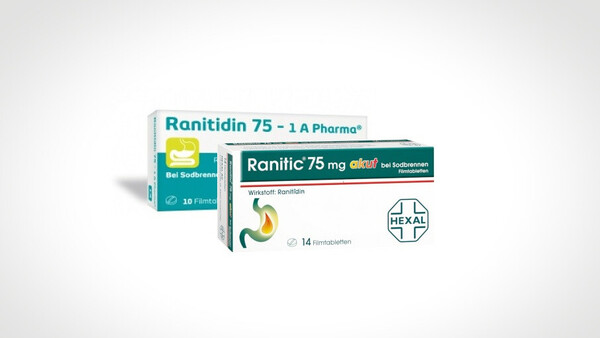
Hexal: Weiterer Ranitidin-Rückruf
Stuttgart - 17.10.2019, 13:59 Uhr

Die US-Arzneimittelbehörde FDA verweist mittlerweile auf eine Testmethode, die Hersteller zum Nachweis von NDMA in Ranitidin anwenden sollen. Diese Methode verhindere, anders als bei Valisure, den Abbau von Ranitidin während der Analyse und somit auch die NDMA-Bildung. ( r / Foto: Slavko Sereda / stock.adobe.com)
Wie die Arzneimittelkommission der Deutschen Apotheker (AMK) am heutigen Donnerstag informiert, wird Ranitic injekt von Hexal zurückgerufen. Interessant daran ist, dass nun auch Spuren der Nitrosaminverunreinigung NDMA in Fertigarzneimitteln und nicht nur im Wirkstoff selbst gefunden wurden.
Erst kürzlich berichtete DAZ.online darüber, dass noch nicht alle Präparate, die das Antazidum Ranitidin als Wirkstoff enthalten, vom deutschen Markt zurückgerufen wurden. Insgesamt erscheint die Rückrufsituation (auch weltweit) eher unübersichtlich. Laut der kanadischen Arzneimittelbehörde (Health Canada) deuten aktuelle Ergebnisse darauf hin, dass NDMA unabhängig vom Hersteller in Ranitidin enthalten sein kann. Der Vertrieb von Ranitidin wurde in Kanada deshalb vorerst komplett eingestellt. Allerdings kommt das keinem Rückruf gleich, sodass Ranitidin, das sich bereits in den Apotheken befindet, noch verkauft werden kann. Zusätzlich sind aber auch in Kanada herstellerbezogene Rückrufe erfolgt.
Mehr zum Thema

Valisure, FDA, EMA und Health Canada
NDMA in Ranitidin: Verunreinigt beim Hersteller oder vom Wirkstoff selbst?

die ersten Rückrufe
NDMA in Ranitidin von Betapharm, Hexal, 1 A Pharma, AbZ und Ratiopharm
In Deutschland verriet Anfang Oktober ein Blick auf die bisherige Rückrufliste der AMK und ein Blick in die Lauer-Taxe, dass (noch) nicht alle Ranitidin-Präparate zurückgerufen worden sind. Zumindest die Ranitidin-Präparate in der rezeptfreien Dosierung mit 75 mg scheinen aber alle gänzlich nicht mehr im Handel zu sein. Bislang gar nicht vom Rückruf betroffen scheinen die Aliud Pharma GmbH, die Axcount Generika GmbH und die Stadapharm GmbH zu sein.
Währenddessen wurde Ranitidin von Betapharm beispielsweise nur chargenbezogen zurückgerufen, bei Ranitidin von Hexal schien die Infusionslösung nicht betroffen zu sein – am heutigen Donnerstag wird nun aber auch letztere durch die Hexal AG zurückgerufen:
Ranitic® injekt 10 mg/ml
5x5 ml, Konzentrat zur Herstellung einer Injektions- oder Infusionslösung
Alle Chargen mit dem Verfalldatum bis einschließlich 10/2020
(PZN 07581514)
soll zur Gutschrift mittels APG-Formular über den pharmazeutischen Großhandel zurückgeschickt werden. Krankenhausapotheken werden um direkte Rücksendung an die Retourenabteilung der Salutas Pharma GmbH gebeten.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.