
- DAZ.online
- News
- Pharmazie
- Dafür gibt es den ...
Der zelluläre Sauerstoffsensor
Dafür gibt es den Medizin-Nobelpreis
07.10.2019, 16:29 Uhr

William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza sind die Medizin-Nobelpreisträger 2019. (c / Foto: The Nobel Assembly at Karolinska Institutet)
Der Nobelpreis für Medizin markiert traditionell den Start in die Nobelpreiswoche. In diesem Jahr geht er an drei Zellforscher aus den USA und Großbritannien: William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza. Sie haben den Mechanismus entschlüsselt, wie Zellen unterschiedliche Sauerstoffverfügbarkeit messen und ihren Metabolismus entsprechend anpassen können. Doch wie genau funktioniert das?
Die meisten Lebewesen benötigen Sauerstoff zur Energiegewinnung. Das ist schon Jahrhunderte bekannt. Allerdings ist nicht immer gleich viel Sauerstoff verfügbar, so sinken zum Beispiel in großer Höhe der Luftdruck und damit der verfügbare Sauerstoff. Dass Zellen sich diesen geänderten Umgebungsbedingungen anpassen können, weiß man ebenfalls schon lange. Das wird auch medizinisch genutzt. So wird beispielsweise bei Hypoxie vermehrt Erythropoietin (EPO) gebildet und somit Erythrozyten, was beispielsweise bei Anämie hilfreich ist. Auch Sportler machen sich dieses Wissen zunutze – im Höhentraining.
Wie Zellen sich diesen geänderten Umgebungsbedingungen anpassen können, wusste man allerdings lange nicht. Für die Entdeckung der Mechanismen, wie Zellen unterschiedlichen Sauerstoffgehalt „fühlen“ und sich entsprechend anpassen, gibt es nun in diesem Jahr den Medizin-Nobelpreis. Die drei Preisträger, William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza, hätten einen der wichtigsten Anpassungsmechanismen überhaupt entschlüsselt, heißt es in einer Pressemitteilung der Nobel-Stiftung am Karolinska-Institut. Sie hätten die Grundlage gelegt, um zu verstehen, wie der Sauerstoffgehalt den Zellstoffwechsel und die Körperfunktionen beeinflusst.
Mehr zum Thema

Anpassung von Zellen an die Sauerstoffverfügbarkeit
Medizin-Nobelpreis für drei Zellforscher
Erythropoietin als Ausgangspunkt
Doch was haben sie genau entdeckt? Im Zentrum ihrer Arbeiten steht ein Proteinkomplex namens HIF. HIF steht für „hypoxia-inducible factor“, also Hypoxie-induzierbarer Faktor. Dieser Proteinkomplex bindet sauerstoffabhängig an ein bestimmtes DNA-Segment. Das befindet sich neben dem Gen für Erythropoietin (EPO) und reguliert dessen Antwort auf Hypoxie, wie Gregg Semenza im Mausmodell herausfand. Diesen sauerstoffabhängigen Mechanismus gibt es übrigens in praktisch allen Geweben, nicht nur in Nierenzellen, wo EPO normalerweise sezerniert wird. Das fand sowohl die Gruppe um Gregg Semenza heraus als auch die von Sir Peter Ratcliffe, der sich ebenfalls mit der Sauerstoff-abhängigen Regulation des EPO-Gens befasst hat.
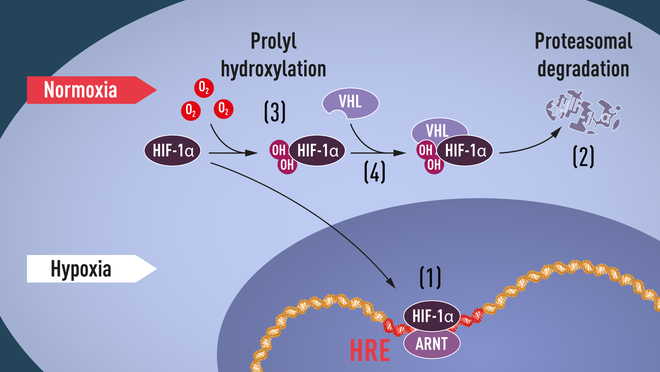
HIF besteht, wie Semenza entdeckte, aus zwei verschiedenen DNA-bindenden Proteinen, sogenannten Transkriptionsfaktoren, die heute HIF-1α und ARNT heißen. Ist der Sauerstoffgehalt der Umgebung hoch, enthalten Zellen wenig HIF-1α. Bei wenig Sauerstoff steigt der Gehalt an HIF-1α, so dass es an die DNA binden kann und das EPO-Gen sowie andere DNA-Abschnitte mit Bindungsstellen für diesen Transkriptionsfaktor regulieren. Mehrere Arbeitsgruppen konnten zeigen, dass HIF-1α unter Normalbedingungen schnell vom Proteasom abgebaut wird, bei Hypoxie jedoch geschützt ist. Bei normalem Sauerstoffgehalt wird HIF-1α mit einem kleinem Protein namens Ubiquitin „markiert“ – für das Proteasom ist das das Signal zum Abbau. Die zentrale Frage war aber, wie Ubiquitin sauerstoffabhängig an HIF-1α bindet.
Antwort kam aus der Krebsforschung
Die Antwort kam unerwarteterweise aus der Krebsforschung. Zur selben Zeit, als Semenza und Ratcliffe sich mit der sauerstoffabhängigen EPO-Regulation befassten, untersuchte William Kaelin eine seltene, autosomal-dominant vererbte Tumorerkrankung namens Von-Hippel-Lindau-Syndrom (VHLS), bei der Erkrankte ein genetisch stark erhöhtes Risiko für Tumore auf der Netzhaut, in Kleinhirn und Rückenmark sowie in der Niere, Nebenniere und der Bauchspeicheldrüse haben. Kaelin konnte zeigen, dass das VHL-Gen für ein Protein codiert, das Krebsentstehung verhindert. Ebenso zeigte er, dass Krebszellen ohne intaktes VHL-Gen hypoxieregulierte Gene extrem überexprimieren. Bringt man ein intaktes VHL-Gen in Krebszellen ein, normalisiert sich die Expression. VHL scheint also in die Anpassungsmechanismen der Zellen bei Hypoxie involviert zu sein – ein wichtiger Hinweis in Bezug auf die Frage, wie Ubiquitin sauerstoffabhängig an HIF-1α bindet. Weitere Hinweise kamen dann von verschiedenen Gruppen, die zeigen konnten, dass VHL Teil des Komplexes ist, der Proteine mit Ubiquitin markiert und sie so für das Proteasom als „Müll“ markiert. Ratcliffe und seine Gruppe machten dann eine entscheidende Entdeckung: VHL kann mit HIF-1α interagieren und ist für den Abbau von HIF-1α bei normalem Sauerstoffgehalt erforderlich.
Auf der Suche nach dem Schlüssel für den „Sauerstoff-Sensor“
Was man aber immer noch nicht wusste, war, wie der Sauerstoffgehalt die Interaktion zwischen zwischen VHL und HIF-1α steuert. Man konzentrierte sich bei der Suche auf einen bestimmten Abschnitt des HIF-1α-Proteins, von dem man wusste, dass es für die VHL-abhängige Degradation wichtig ist. Kaelin und Ratcliffe vermuteten den Schlüssel für den „Sauerstoff-Sensor“ irgendwo in diesem Bereich des Proteins. 2001 publizierten sie zeitgleich einen Artikel, in dem sie beschreiben, dass HIF-1α bei normalem Sauerstoffgehalt an zwei spezifischen Positionen hydroxyliert wird. Diese sogenannte Prolyl-Hydroxylierung erlaubt VHL HIF-1α zu erkennen und daran zu binden. Zudem ist sie die Erklärung dafür, wie normaler Sauerstoffgehalt mit Hilfe sauerstoffsensitiver Enzyme, den Prolyl-Hydroxylasen, den schnellen HIF-1α-Abbau triggert. Später konnte unter anderem Ratcliffe die verantwortlichen Prolyl-Hydroxylasen auch identifizieren. Außerdem konnte nachgewiesen werden, dass die genaktivierende Funktion von HIF-1α ebenfalls durch sauerstoffabhängige Hydroxylierung gesteuert wird. Somit hatten die Nobel-Preisträger den Mechanismus des zellulären Sauerstoffsensors entschlüsselt.
Der praktische Nutzen
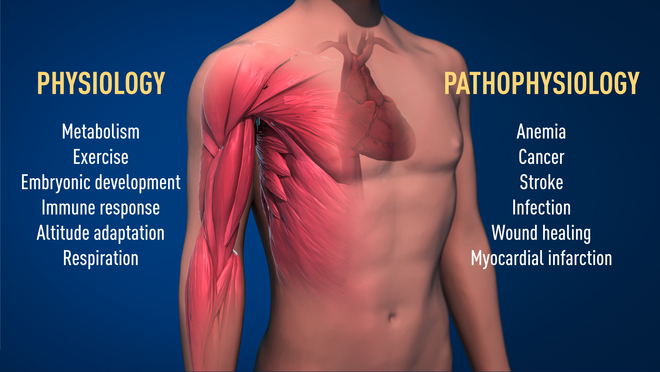
Aufgrund ihrer Arbeit wisse man heute viel mehr darüber, wie Sauerstoff fundamentale physiologische Prozesse regle, heißt es in der Mitteilung des Nobel-Komitees. Als Beispiel werden Muskelzellen bei investiver Belastung genannt oder die Bildung neuer Blutgefäße. Zudem spiele dieser sauerstoffabhängige Mechanismus eine Rolle bei zahlreichen Erkrankungen. So litten niereninsuffziente Patienten oft unter Anämie aufgrund einer reduzierten EPO-Expression. Auch bei Krebs spiele der entdeckte Weg eine wichtige Rolle, weil er dafür sorge, dass für ein effektives Tumorwachstum Gefäße neu- und der Zellstoffwechsel umgebildet werde. An Arzneimitteln, die diesen Mechanismus (oxygen-sensing machinery) entweder blockieren oder stimulieren können, werde bereits intensiv geforscht

























1 Kommentar
Das Kommentieren ist aktuell nicht möglich.