
- DAZ.online
- News
- Apotheke
- Zoely zentral zugelassen...
Gesetzliche Lücke im AMG
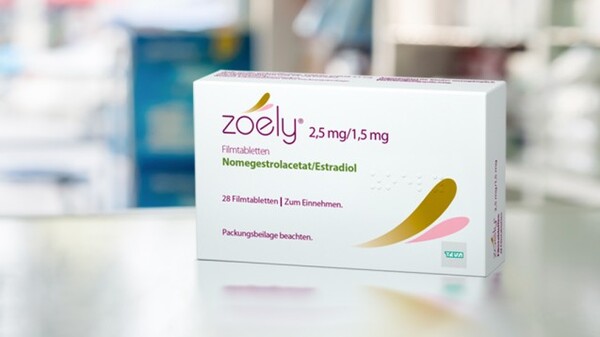
Zoely zentral zugelassen – ist ein Import nach § 73 Abs. 3 überhaupt erlaubt?
Stuttgart - 14.06.2019, 07:00 Uhr

Ist ein Einzelimport nach § 73 Abs. 3 AMG möglich, wenn es um zentral zugelassene Arzneimittel geht? (s / Foto: nmann77 / stock.adobe.com)
Das Dilemma mit der deutschen Packungsbeilage
Das Arzneimittelgesetz enthält zahlreiche und detaillierte Vorgben. So erklärt der Gesetzgeber in § 10 AMG die Kennzeichnung von Arzneimitteln, und dass Fertigarzneimittel, die weder der klinischen Prüfung dienen noch von der Zulassungspflicht freigestellt sind „im Geltungsbereich dieses Gesetzes nur in den Verkehr gebracht werden (dürfen), wenn auf den Behältnissen und, soweit verwendet, auf den äußeren Umhüllungen in gut lesbarer Schrift, allgemeinverständlich in deutscher Sprache und auf dauerhafte Weise" bestimmte Angaben gemacht sind. Gleiches gilt für die Packungsbeilage nach § 11 AMG.
Ein Dilemma: Zentral zugelassen und somit eigentlich kein Import nach § 73 Abs. 3 AMG, aber einfach so verbringen darf man Zoely auch nicht, da die deutsche Kennzeichnung und Packungsbeilage fehlt. Dieses gesetzliche Vakuum existiert nicht erst seit Zoely®, sondern seit einer EU-Verordnung vom 31. März 2004, die es ermöglicht hat, Arzneimittel für alle Länder der EU zentral zuzulassen. Ist dies denn seither niemandem aufgefallen? Scheinbar schon. Doch man ist sich uneins.
„Deutsche Kleinstaaterei blockiert sichere Arzneimittelversorgung“
Sabine Fuchsberger-Paukert, Vorsitzende des Verbands der Einzelimporteure internationaler Arzneimittel e.V. (VEIA), erklärt gegenüber DAZ.online: Der Bezug zentral zugelassener Arzneimittel, die in Deutschland nicht lieferbar sind, wird von den Länderbehörden unterschiedlich interpretiert: Ob man also die Verhütungspille Zoely® über einen Einzelimport beziehen kann, hängt davon ab, ob man in Bayern, Hessen, Nordrhein-Westfalen oder Mecklenburg-Vorpommern wohnt", so Fuchsberger-Paukert. Weil sich die Länderaufsicht nicht auf eine einheitliche Rechtsauffassung verständigen könne, bestehe die Gefahr, dass Anwenderinnen die Präparate auf dem Graumarkt oder illegal beschafften, so die Sorge der VEIA-Vorsitzenden.Sie findet: „Die deutsche Kleinstaaterei blockiert eine sichere Arzneimittelversorgung“.






















4 Kommentare
Will doch sowieso niemand....
von Christian Becker am 14.06.2019 um 9:25 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Was spricht denn gegen...
von Michael Mischer am 14.06.2019 um 8:15 Uhr
» Auf diesen Kommentar antworten | 2 Antworten
AW: Was spricht denn gegen
von A. L. am 14.06.2019 um 8:39 Uhr
AW: Was spricht denn gegen
von Michael Mischer am 14.06.2019 um 8:48 Uhr
Das Kommentieren ist aktuell nicht möglich.