
- DAZ.online
- News
- Pharmazie
- ATMP – die ...
Bionnale 2019
ATMP – die Herausforderungen: Entwicklung, Herstellung und Kostenerstattung!
Berlin - 17.05.2019, 09:00 Uhr

Nicht nur schwierig in der Entwicklung, auch die Erstattung seitens der Krankenkassen stellt eine Herausforderung für ATMP dar.Teilweise wurden ATMP aus wirtschaftlichen Gründen bereits wieder vom Markt genommen. (r / Foto: nobeastsofierce / stock.adobe.com)
Wunder der Gentherapie, endlich individualisierte und zielgerichtete Behandlungen, eine Therapie-Revolution – diese euphorisch stimmenden Wendungen haben Advanced Therapy Medicinal Products (ATMPs) durchaus für sich gepachtet. So faszinierend die therapeutischen Möglichkeiten sind, die sich durch ATMPs auftun, so groß sind die Hürden, die ATMPs von der Entwicklung bis zur Applikation am Patienten nehmen müssen. Zurückgenommen werden sie wohl nicht aus Sicherheitsgründen, sondern aus kommerziellen. Das wurde bei der Bionnale 2019 in Berlin deutlich.
Heilen Gentherapien? Laut Dr. Christoph Prinz bei der Bionnale 2019 – der größten Netzwerk-Veranstaltung für die Life-Science- und Gesundheitsbranche in der deutschen Hauptstadtregion – in der vergangenen Woche in Berlin haben „Gentherapien das Potenzial zu heilen und nicht nur die Symptome zu behandeln“. Und „Heilung“ gilt sicherlich als höchstes Ziel einer Arzneimitteltherapie.
Arzneimittel sind Stoffe oder Zubereitungen aus Stoffen, die zur Anwendung im oder am menschlichen oder tierischen Körper bestimmt sind und als Mittel mit Eigenschaften zur Heilung oder Linderung oder zur Verhütung menschlicher oder tierischer Krankheiten oder krankhafter Beschwerden bestimmt sind (...)“
§ 2 Arzneimittelbegriff, Arzneimittelgesetz
Die Therapiemöglichkeiten, die sich durch ATMPs – Advanced Therapy Medicinal Products – auftun,
begeistern tatsächlich. Gefühlt bekommen sie erst in jüngst richtige
Aufmerksamkeit. Allerdings: Zugelassen wurde das erste bereits vor rund zehn
Jahren. Jedoch hat es nicht jedes ATMP geschafft, im Markt zu bestehen.
Zulassungsrücknahme nicht aus Sicherheitsgründen
Manche Hersteller haben in den letzten Jahren aus eigenen Stücken die Zulassung ihrer innovativen Produkte zurückgenommen. Dies sei, so Prinz, vor allem aus „kommerziellen Gründen“ geschehen. Prinz ist Apotheker und arbeite als Head of Quality Management bei Apceth Biopharma. Nach eigenen Angaben ist das 2007 gegründete und in München ansässige Unternehmen „Pionier auf dem Gebiet der Zell- und Gentherapie“ und europäisch führend bei der Entwicklung und Herstellung von ATMPs, zu denen auch Gentherapien gehören.
Therapiekosten werden auf einmal ausgelöst
Entwicklung und Herstellung sind mitnichten die einzigen Herausforderungen, denen sich ATMPs – sprich Gentherapien, somatische Zelltherapien und biotechnologisch bearbeitete Gewebeprodukte – stellen müssen.
Die Hürde neben der Wissenschaft ist die Kostenerstattung. Vor allem diese sorgt medial immer wieder für Aufsehen – manchmal fast sogar mehr als der wissenschaftliche Fortschritt. „Historisch“ bekannt bei den Kosten von ATMPs ist sicherlich die One-Million-Dollar-Therapie mit Glyebera. Mit n = 1 behandelten Patienten nahm Hersteller Uniqure das Alipogene-tiparvovec-haltige Arzneimittel 2017 wieder vom Markt. „Kommerzielle Gründe lassen Glybera heute nicht mehr verfügbar sein“, erklärt Prinz. Mit einer Million bei Glybera war allerdings das Ende der Fahnenstange hinsichtlich des Arzneimittelpreises längst nicht erreicht. Jüngst brachte Novartis vier bis fünf Millionen Dollar Therapiekosten für das bei Spinaler Muskelatrophie (SMA) zur Zulassung eingereichte Zolgensma ins Spiel – Novartis erwartet die US-amerikanische Zulassung noch im Mai 2019 und in der EU und Japan im Laufe des Jahres.
Mehr zum Thema

Spinraza bei spinaler Muskelatrophie
Mehr Erfolg mit Nusinersen durch Neugeborenen-Screening auf SMA?

Spinale Muskelatrophie
Nusinersen: Ausmaß des Zusatznutzens? Erheblich!
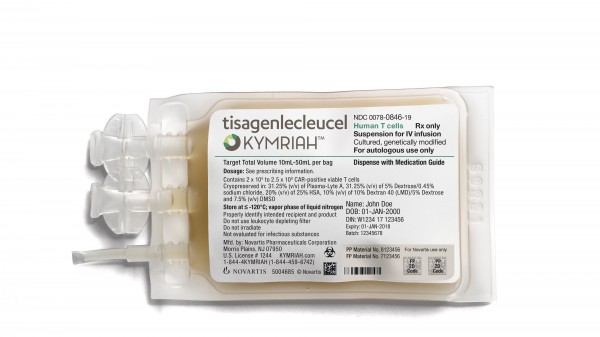
Das Besondere an der Erstattungssituation von Gentherapien wie den CAR-T-Präparaten Kymriah (Tisagenlecleucel) und Yescarta (Axicabtagen Ciloleucel) oder Strimvelis zur Behandlung von ADA-SCID, einer auf einem seltenen Gendefekt beruhenden Immundefizienzerkrankung: Die Therapiekosten „plätschern“ nicht über Jahre dahin und belasten das Budget der Krankenkassen sukzessive. Sie werden geballt auf einmal fällig.
Das bedeutet jedoch nicht unbedingt, dass ATMPs im Großen und Ganzen die Kassen sodann teurer zu stehen kommen. Prinz erklärt anhand von Strimvelis, dass eine konservative Therapie von ADA-SCID mit einer ADA-Enzymersatztherapie jährlich zwischen 100.000 bis 300.000 Euro kostet. Die „mögliche“ Heilung mit Strimvelis liegt bei etwa 600.000 Euro. Strimvelis wurde 2016 von der EU für die sehr seltenen Erkrankung namens ADA-SCID oder schwere kombinierte Immunschwäche aufgrund Adenosindeaminase-Mangels zugelassen, der ADA-Mangel führt infolge eines Mangels an Lymphozyten zu schweren Immundefekten, unbehandelt sterben die Kinder meist innerhalb eines Jahres. Vor Strimvelis galt die Knochenmarktransplantation als Standardtherapie, einzige Alternative war bislang eine ADA-Enzymersatztherapie mittels Injektion.
„Wert der Therapie darf nicht nur auf Kosten beruhen“
Auch Dr. Katja Schmidt von Novartis kommt zu diesem Schluss. Das Spezielle am „Reimbursement“ von ATMP, als Beispiel nennt sie das Novartis-CAR-T-Zell-Präparat Kymriah, sei die Einmalbehandlung. Denn auch eine Stammzelltransplantation treffe die Kostenträgern mit 300.000 bis 500.000 Euro – jedoch nicht auf einmal. „Die Kosten der allogenen Stammzelltransplantation können in Deutschland eine breite Spannbreite einnehmen. Dies ist abhängig von der Art der Behandlung, den Vortherapien, dem Alter des Patienten und der Behandlungsdauer, so dass die Kosten bei bis zu mehreren hunderttausend Euro liegen. Diese Kosten können die Kostenträger über einen Zeitraum von mehreren Jahren treffen,“ fasst Schmidt zusammen.
Tisagenlecleucel wird bei Kindern, Jugendlichen und jungen erwachsenen Patienten mit B-Zell-ALL und bei Erwachsenen mit diffus großzelligen B-ZellLymphom (DLBCL) eingesetzt. Die Therapie ist nicht First-Line, sie kommt derzeit für austherapierte Patienten infrage, die ansonsten optionslos sind. Möglichkeiten zum Verhandeln gibt es hier mit den Kassen, auch Novartis ist diesen Weg gegangen und hat mit den Kostenträgern Pay-by-Outcome-Verträge geschlossen.
Heilung wird greifbar
Was hier droht, fast in Vergessenheit zu geraten oder nebensächlich zu werden: der Wert der Therapien für den Patienten. Laut Schmidt liegt die Lebensdauer von Kymriah-Patienten ohne weitere Therapie bei drei bis sechs Monaten. Die Überlebenskurven von Studien zeigten, dass durch Tisagenlecleucel bei DLBCL im 24-Monate-Follow-up vier von sechs Patienten noch refraktär und am Leben seien. „Heilung wird greifbar", so Schmidt.
Dass ATMP teuer sind, steht außer Frage. Prinz mahnt jedoch gleichzeitig: „Der Wert der Therapie darf nicht nur auf Kosten beruhen“.
Derzeit zielen ATMPs auf austherapierte Patienten und seltene Erkrankungen ab. Neun ATMPs sind EU-weit zugelassen, 977 klinische Studien laufen weltweit, davon befinden sich 93 bereits in Phase-III.
Der Einsatz ist aktuell noch überschaubar. Problematisch dürfte die Kostenerstattung dann zusätzlich werden, wenn durch therapeutische Erfahrung die Therapien in den Behandlungshierarchien weiter nach vorne rücken und neben seltenen Erkrankungen zunehmend auch „common diseases" behandelt werden.
ATMP: Was gehört dazu?
ATMP – Advanced Therapy Medicinal Product: Dazu zählen Gentherapien, somatische Zelltherapien und biotechnologisch bearbeitete Gewebeprodukte. Diese Arzneimittel für neuartige Therapien müssen zwingend in einem zentralen Zulassungsverfahren bei der EMA zugelassen werden, zuständig dort ist das Committee for Advanced Therapies (CAT). In Deutschland fallen ATMP in den Verantwortungsbereich des Paul-Ehrlich-Institutes.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.