
- DAZ.online
- News
- Politik
- Hämophilie-Arzneimittel...
GSAV-Änderungsanträge
Hämophilie-Arzneimittel: Apotheker sollen Daten an Ärzte melden müssen
Stuttgart - 13.05.2019, 16:50 Uhr
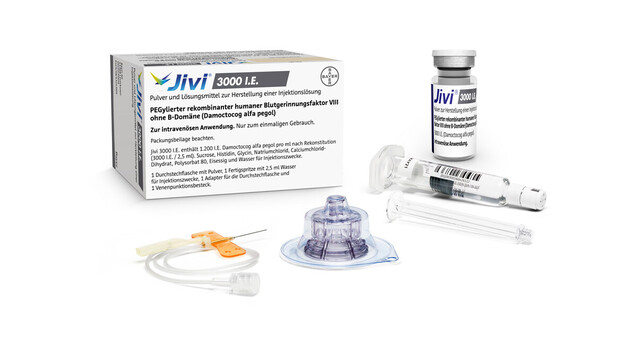
Arzneimittel zur Hämophilie-Behandlung, wie Jivi, bekamen Apotheken bislang nicht zu Gesicht. Das wird sich ändern. (m / Foto: picture alliance / Bayer Vital GmbH / obs)
Laut dem Entwurf für das Gesetz für mehr Sicherheit in der
Arzneimittelversorgung (GSAV) sollen Arzneimittel zur Hämophilie-Behandlung
künftig über Apotheken vertrieben werden. Apotheken sollen aber alle
relevanten Behandlungsdaten an die verschreibenden Ärzte melden müssen. Letzteres
sieht ein Änderungsantrag der Regierungsfraktionen vor. Außerdem sollen die
Aufzeichnungspflichten künftig nicht nur für Plasmaproteine gelten, sondern für
alle Arzneimittel aus diesem Therapiebereich, also auch für Antikörper.
Viele Arzneimittel, die zur Behandlung von Blutern eingesetzt werden, zum Beispiel Gerinnungsfaktor-Zubereitungen, waren bislang vom einheitlichen Vertriebsweg über die Apotheke ausgenommen. Sie wurden direkt von den Herstellern an spezialisierte Ärzte und Zentren verkauft. Mit dem Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV) soll sich das in Zukunft ändern. Die Ausnahmen vom Vertriebsweg über Apotheken sollen auf Blutzubereitungen beschränkt werden, die aus menschlichem Blut gewonnen werden. Sie sollen dagegen nicht mehr für plasmatische und gentechnologisch hergestellte Gerinnungsfaktorzubereitungen gelten. Diese sollen gemäß dem Entwurf künftig ebenso wie die zunehmend eingesetzten monoklonalen Antikörper den einheitlichen Vertriebsweg über die Apotheke nehmen.
Mehr zum Thema
GSAV-Gesetzentwurf
Arzneimittel gegen Hämophilie sollen apothekenpflichtig werden

Hämophilie-Versorgung
Schulz-Asche: Die Apotheken wollen natürlich auch mitverdienen!
Erweiterung der Dokumentationspflichten auf Antikörper
Die Meinungen darüber, ob das eine gute Idee ist oder nicht, gehen auseinander. Während beispielsweise die Länder den Plan der Regierung ablehnen, begrüßt die ABDA diese vorgesehene Änderung. Nun liegen die Änderungsanträge der Regierungsfraktionen vor und sie betreffen unter anderem auch diesen Punkt. Ganz am Ende des 30 Punkte umfassenden Pakets gehen die Fraktionen von Union und SPD darauf ein. Die Änderungsanträge betreffen die Apothekenbetriebsordnung.
Zum einen soll § 17 Absatz 6a ApoBetrO, der sich um die Dokumetationspflichten gemäß Tranfusiosngesetz dreht, dahingehend geändert werden, dass die Wörter „gentechnisch hergestellten Plasmaproteinen zur Behandlung von Hämostasestörungen“ durch die Wörter „Arzneimitteln zur spezifischen Therapie von Gerinnungsstörungen bei Hämophilie“ ersetzt werden. Damit wollen die Regierungsfraktionen den neuen Entwicklungen in dieser Therapie Rechnung tragen, wie es in der Begründung heißt. Hintergrund ist, dass zur Hämophile-Behandlung nicht mehr nur Gerinnungsfaktoren zum Einsatz kommen, sondern zum Beispiel auch Antikörper, wie das 2018 zugelassene Emicizumab (Hemlibra®).
Was müssen Apotheker künftig melden?
Der zweite Teil des Änderungsantrags bezieht sich auf die Meldepflichten der Apotheker. Demnach soll § 17 Absatz 6a ApoBetrO folgendermaßen ergänz werden: „Dem verschreibenden Arzt sind folgende Angaben zu melden:
1. die Bezeichnung des Arzneimittels,
2. die Chargenbezeichnung und die Menge des Arzneimittels,
3. das Datum der Abgabe und
4. Name, Vorname, Geburtsdatum und Wohnort des Patienten.
Die Meldung hat elektronisch oder schriftlich nach Abgabe des Arzneimittels zu erfolgen.“
Mehr zum Thema

Mehr Sicherheit in der Arzneimittelversorgung
GSAV-Entwurf im Bundeskabinett

GSAV-Regierungsentwurf
Spahn will Importklausel nun doch neu fassen statt streichen
Datenmeldung an Hämophiliezentren soll sichergestellt werden
In der Begründung heißt es, dass bislang, bedingt durch den bisherigen
Vertriebsweg, den behandelnden Ärzten alle für die Meldung an das Deutsche
Hämophilieregister relevanten Behandlungsdaten vorlagen. Durch die Überführung
aller Arzneimittel zur spezifischen Therapie von Gerinnungsstörungen bei
Hämophilie in den einheitlichen Vertriebsweg über die Apotheke lägen diese
Daten zum Teil aber nur noch bei der abgebenden Apotheke vor, insbesondere
Bezeichnung des Arzneimittels und Chargennummer. Um die Datenmeldung vom behandelnden
Arzt an das Deutsche Hämophiliezentrum sicherzustellen, sollen die Apotheken
verpflichtet werden, diese Daten dem verschreibenden Arzt zu übermitteln, heißt es.
Sind die Änderungsanträge der Regierungsfraktionen eingearbeitet, steht im nächsten Schritt des Gesetzgebungsverfahrens die 2./3. Lesung im Bundestag an. Zum Schluss muss der Bundesrat zustimmen. In Kraft treten soll das Gesetz im Sommer.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.