
- DAZ.online
- News
- Pharmazie
- PUMA-Arzneimittel: Eine ...
Melatonin, Hydrocortison & Co. für Kinder
PUMA-Arzneimittel: Eine bedrohte Spezies?
Stuttgart - 20.04.2019, 08:00 Uhr
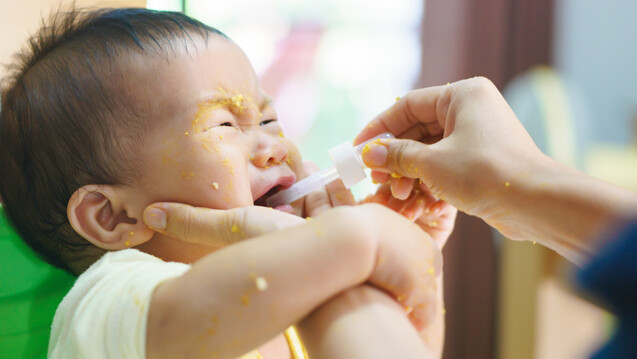
Wenn es schon beim Füttern Probleme gibt … Kinder zeigen sich bei der Arzneimitteleinnahme oft unkooperativ. (s / Foto: bonnontawat / stock.adobe.com)
Wenn die zweckmäßige Vergleichstherapie kein Placebo ist
Nach den Vorgaben des G-BA hätte der Zusatznutzen von Melatonin in Slenyto® gegenüber „Best supportive Care“ (BSC) als zweckmäßige Vergleichstherapie gezeigt werden müssen – in der Indikation: Behandlung von Schlafstörungen bei Kindern und Jugendlichen im Alter von zwei bis 18 Jahren mit Autismus-Spektrum-Störung und / oder Smith-Magenis-Syndrom, wenn Schlafhygienemaßnahmen unzureichend waren.
Dieser Vorgabe des G-BAs sei der pharmazeutische Unternehmer formal auch gefolgt, indem er die BSC als zweckmäßige Vergleichstherapie benennt. Allerdings betrachte der pharmazeutische Unternehmer in der Studienpraxis die BSC durch eine Placebo-Kontrolle als erfüllt. Der G-BA versteht unter der BSC aber kein Placebo, sondern „begleitende/fortführende psychotherapeutische Maßnahmen entsprechend Psychotherapieleitlinie“, die sowohl Teil des Interventionsarms als auch des Vergleicharms sein sollten.
Die vom pharmazeutischen Unternehmer herangezogene Studie (NEU_CH_7911) ist eine doppelblinde RCT, die Melatonin mit Placebo vergleicht und 125 an Schlafstörungen leidende Kinder im Alter von zwei bis 17,5 Jahren untersucht, die zuvor unzureichend auf Schlafhygienemaßnahmen angesprochen hatten (mit Autismus-Spektrum-Störung und / oder bestimmten neurogenetischen Erkrankungen).
Es ist also nicht so, dass die Kinder nie andere Behandlungsmöglichkeiten zur Verfügung hatten. Denn diejenigen, die in der Vergangenheit noch keine dokumentierte Verhaltenstherapie (Schlafhygienemaßnahmen) erhalten hatten, durchliefen vor Studienbeginn noch eine vierwöchige Basistherapie mit Schlafhygienetraining und Verhaltenstherapie.
Warum der pharmazeutische Hersteller diese Maßnahmen dann aber nicht in beiden Studienarmen fortgeführt hat, bleibt offen – vielleicht wäre das Urteil des G-BA dann anders ausgefallen. So wurde die Studie – auch aufgrund anderer Limitationen – jedenfalls nicht für die Nutzenbewertung herangezogen. Direkt vergleichbar sind die Fälle Alkindi® (gar keine Vergleichstherapie) und Slenyto® somit eher nicht.
Mehr zum Thema

Rote-Hand-Brief
Buccolam: Die durchsichtige Kappe muss weg
Seit dem 1. Januar 2011 werden alle Arzneimittel mit neuen Wirkstoffen sowie Indikationserweiterungen von Arzneimitteln, deren Wirkstoff erstmals ab 2011 in den Verkehr gebracht wurde, einer frühen Nutzenbewertung unterzogen. Buccolam® (Midazolam), das im Juni 2011 zum ersten Mal überhaupt für eine PUMA-Zulassung empfohlen wurde, erhielt jedoch noch keine Nutzenbewertung. Anders bei Hemangiol® (Propranolol), das 2014 die zweite PUMA-Zulassungsempfehlung erhielt.
|
Wirkstoff |
Darreichungsform |
Indikation |
Zusatznutzen |
|---|---|---|---|
|
Midazolam (Buccolam®) |
oromukosale Lösung |
Epilepsie (akute Krämpfe), 3 Monate bis 18 Jahre |
Nicht bewertet |
|
Propranolol hydrochlorid (Hemangiol®) |
Lösung zum Einnehmen |
Hämangiom (proliferativ), ab 5 Wochen bis 5 Monate |
ja! |
|
Glycopyrroniumbromid (Sialanar®) |
Lösung zum Einnehmen |
Sialorrhö (chronischer krankhaft gesteigerter Speichelfluss), ab 3 Jahren |
nein |
|
Hydrocortison (Alkindi®) |
Granulat in Kapsel |
Nebennieren-Insuffizienz, ab Geburt |
nein |
|
Melatonin (Slenyto®) |
Retardtabletten |
Schlafstörungen bei Autismus-Spektrum-Störungen, ab 2 Jahren |
nein? |
|
Vigabatrin (Kigabeq®) |
soll als lösliche Tablette erhältlich sein, die sich in weiteren 50-mg-Schritten teilen und so an das Körpergewicht anpassen lässt |
West-Syndrom, auch bekannt als BNS-Epilepsie (Blitz-Nick-Salaam) und bei Kindern im Lebensalter von 1 Monat bis 7 Jahre, die an resistenter fokaler Epilepsie leiden |
hat 2018 die Zulassung erhalten und soll in Deutschland am 1. Juli 2019 auf den Markt kommen |
In einer Liste des Verbands der Forschenden Arzneimittelhersteller e.V. (vfa) vom 25. März 2019 finden sich Zulassungen und Zulassungserweiterungen für Arzneimittel oder Applikationshilfen für Kinder und Jugendliche seit 2001. Die oben in der Tabelle (chronologisch) aufgeführten Präparate verfügen über eine PUMA-Zulassung (patentfreies, speziell für Kinder entwickeltes Produkt).






















1 Kommentar
Kigabeq
von Dr Schweikert-Wehner am 20.04.2019 um 10:36 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.