PASI: Was ist das?
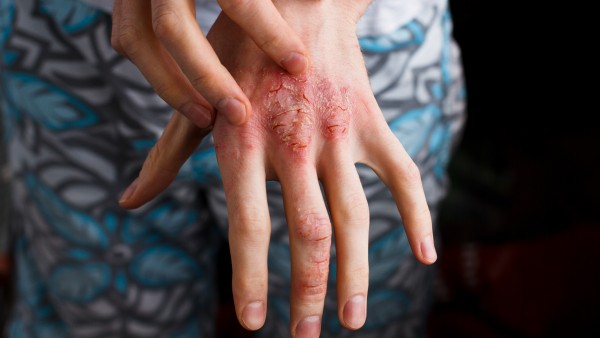
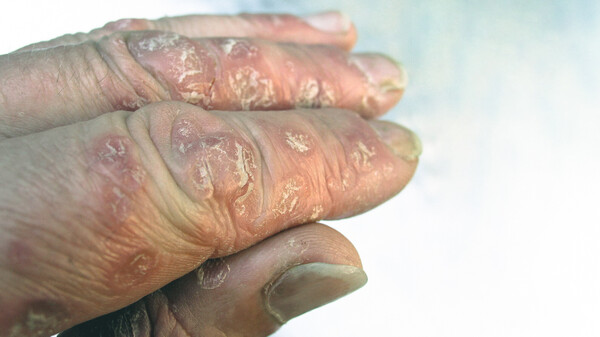
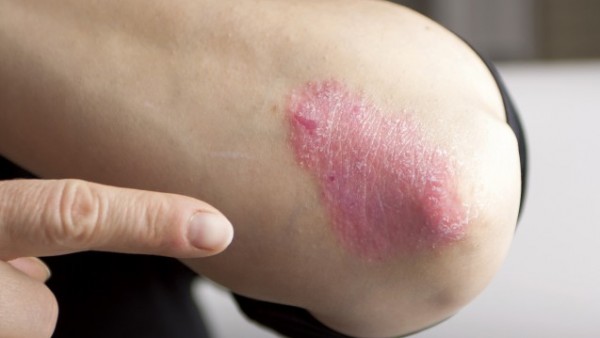
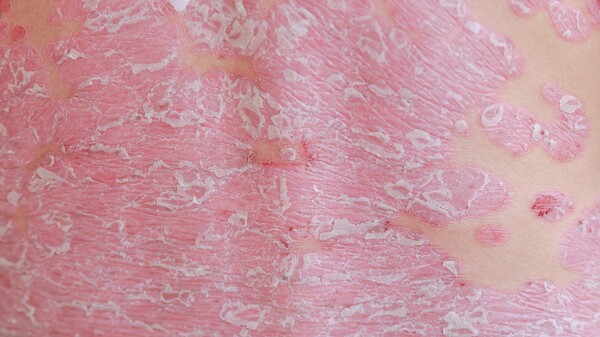
Der PASI, Psoriasis Area Severity Index, bestimmt den Schweregrad der Schuppenflechte: leicht, mittelschwer, schwer. Rötung, Verdickung, Schuppung und die Ausdehnung der von Psoriasis betroffenen Hautfläche fließen als Bewertungsparameter mit ein. Dabei wird der Körper in vier Regionen unterteilt und die jeweiligen Hautläsionen bewertet.
Der PASI kann Werte zwischen 0 und 72 annehmen, wobei man bei Werten
- ≤ 10 von leichter,
- 10 - 50 von mittelschwerer,
- > 50 schwerer
Psoriasis spricht. Vor allem für mittelschwere und schwere Formen der Psoriasis erlaubt der PASI eine zuverlässige Einschätzung. Liegen leichte Formen der Schuppenflechte vor, gewährleistet der PASI keine sichere Einschätzung des Schweregrades mehr.
Eine PASI-90-Reduktion entspricht einer Symptomverbesserung der Haut um 90 Prozent vom Ausgangswert. Ein PASI-100-Ansprechen entspricht einer vollständigen klinischen Remission, das heißt einer Erscheinungsfreiheit.





















1 Kommentar
Irreführende Überschrift
von W. Adolf am 18.03.2019 um 9:51 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.