
- DAZ.online
- News
- Spektrum
- FDA startet Pilotprojekte...
USA
FDA startet Pilotprojekte zum Arzneimittel-Fälschungsschutz
Remagen - 20.02.2019, 10:15 Uhr

Die US-Arzneimittelbehörde FDA startet erste Versuche mit einem nationalen Fälschungsschutzsystem. ( r / Foto: FDA)
Die Vereinigten Staaten sind in Sachen Fälschungsschutz bei Arzneimitteln lange noch nicht so weit wie die Europäer. Es gibt zwar ein Gesetz, mit dem ein umfassendes Nachverfolgungssystem für die Handelskanäle installiert werden soll, aber das soll erst in vier Jahren voll funktionieren. Nun geht es in die Erprobung über verschiedene Pilotprojekte.
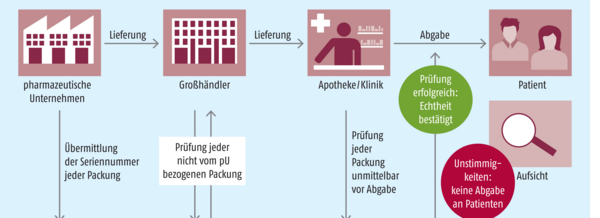
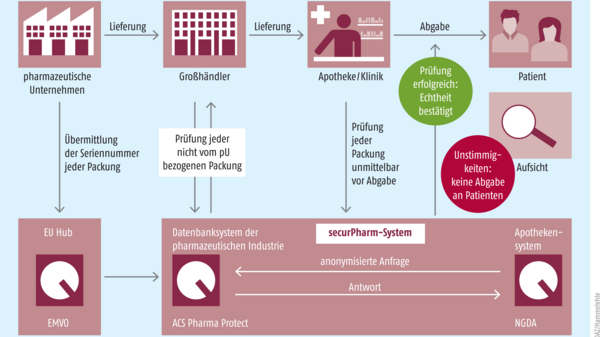
In den USA wurde am 27. November 2013 ein Gesetz vom Kongress verabschiedet, mit dem ein elektronisches, interoperables System für die Verfolgung bestimmter verschreibungspflichtiger Medikamente (Track & Trace) in den Vertriebskanälen im Inland eingerichtet werden soll. Das Ziel des Drug Supply Chain Security Act (DSCSA) ist, den Eintritt von Arzneimittelfälschungen in die legale Lieferkette zu verhindern und sie gegebenenfalls frühzeitig zu erkennen und auszusondern, damit sie nicht zu den Patienten gelangen.
Das Gesetz wird seit November 2014 schrittweise umgesetzt. Einige Schlüsselelemente wie das Tracing auf der Ebene der Chargennummern wurden schon 2015 auf den Weg gebracht. Dabei wurden die Hersteller und Umverpacker, der Großhandel und die Apotheken einbezogen. Sie sollen Informationen für die Verfolgung der Präparate liefern und austauschen. Das komplette Track-and-Trace-System soll aber erst bis zum 27. November 2023 stehen.
Bewerbungsphase läuft
Nach dem Gesetz soll die FDA Ansätze für eine verbesserte Rückverfolgung und Verifizierung der Präparate in einem Programm von Pilotprojekten testen lassen (DSCSA Pilot Project Program). Dieses Programm wird nun gestartet. Die verschiedenen Beteiligten an der Arzneimittelversorgungskette können sich vom 8. Februar bis zum 11. März 2019 für die Teilnahme bewerben. Nach dem Wunsch der FDA soll das Programm die Diversität der Lieferkette ausreichend abbilden, das heißt, es sollen möglichst große und kleine Unternehmen aller Industriesektoren mitmachen. In den Projekten sollen Kernelemente und Aspekte wie die Produktkennung, Barcodes, die Interoperabilität, Fragen im Zusammenhang mit den Daten/Datenbanken und der Verifizierung sowie der Umgang mit Ausnahmen, Fehlern und Inkonsistenzen untersucht werden.
Genau erfassen, wo ein Arzneimittel ist
„Im Rahmen unserer kontinuierlichen Bemühungen, das Arzneimittelangebot unseres Landes zu schützen, geben wir der Industrie heute die Möglichkeit, neue Technologien zu testen“, sagt FDA-Commissioner Scott Gottlieb. „Wir gehen davon aus, dass wir den Eintrag illegaler Produkte in unseren geschlossenen Systemen mit innovativen Ansätzen besser erkennen und die Beteiligten und die FDA dann schneller auf solche Produkte reagieren können. Damit erhöhen wir die Sicherheit des Systems insgesamt.“
Mit Hilfe des angestrebten Track-and-Trace-Systems sollen die von dem System betroffenen Arzneimittel lückenlos verfolgt werden können, erläutert Scott weiter. Es solle Schritt für Schritt erfasst werden können, wo sich ein Arzneimittel befindet und wer damit umgegangen ist, um sicherzustellen, dass es legal im Markt ist und nicht manipuliert wurde. Außerdem müssten alle am Umgang mit Medikamenten beteiligten Personen in der Lieferkette in die Lage versetzt werden, verdächtige Arzneimittel ausfindig zu machen, zu isolieren und zu untersuchen. Das DSCSA-Pilotprojektprogramm soll helfen, die effizientesten Prozesse hierfür zu ermitteln und zu bewerten.
Leitlinien für die Produktkennung und Verifizierung
Erste Schritte, um die Entwicklung und Einführung entsprechender Technologien voranzubringen, hat die FDA bereits unternommen. Zum Beispiel wurde im September 2018 ein Leitlinienentwurf für die Verwendung von Produktkennungen mit einer eindeutigen Seriennummer herausgegeben, um die Überprüfung auf Verpackungsebene zu verbessern. Darüber hinaus hat die Behörde im Oktober 2018 einen Leitlinienentwurf für Verifizierungssysteme bekannt gemacht, zu dem die Hersteller, Großhändler, Apotheken und Verpackungsbetriebe Stellung nehmen können.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.