
- DAZ.online
- News
- Apotheke
- Fragen und Antworten zu ...
Was Apotheker zum Start wissen müssen (teil 2)
Fragen und Antworten zu Securpharm
Stuttgart - 07.02.2019, 17:50 Uhr

Mit der Musterpackung scheint alles ganz einfach, im Echtbetrieb gibt es dann doch viele Fragen (c / Foto: Securpharm)
Der Countdown läuft. Nur noch zwei Tage bis zum Start von Securpharm. Und immer noch gibt es viele offene Fragen bei den Apothekern – Securpharm e.V. hat zwar mittlerweile Handlungsempfehlungen für die Anlaufphase veröffentlicht. Doch wie es wirklich läuft, wird sich erst im Echtbetrieb zeigen. Wir haben einige wichtige Fragen und Antworten zusammengestellt. Im zweiten Teil geht es unter anderem um den Umgang mit Fehlermeldungen und den Erstöffnungsschutz.
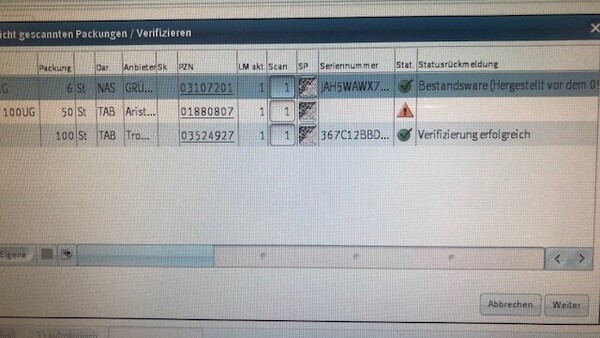
Der Data-Matrix-Code ist auf schwarzem Untergrund. Kann das sein?
Sicherheitsmerkmale können auch auf dunklem Untergrund gedruckt werden. Scanner müssen so eingestellt sein, dass sie diese Codes erkennen.
Es gibt gar keinen Data-Matrix-Code. Was tun?
Wenn es sich um Bestandsware handelt, wird, wie bisher auch, der Barcode gescannt. Ist es keine Bestandsware, ist von einem Fälschungsverdachtsfall auszugehen, der an die AMK und die Aufsichtsbehörde gemeldet werden muss.
Die Packung ist ganz sicher schon älter, hat aber einen Data-Matrix-Code. Was muss ich scannen?
Wenn es ich zweifelsfrei um Bestandsware handelt, kann weiterhin der Strichcode (Code 39) gescannt werden.
Mehr zum Thema

Was Apotheker zum Start wissen müssen (Teil 1)
Fragen und Antworten zu Securpharm

Securpharm informiert
So kommen Apotheken durch die Securpharm-Anlaufphase
Was bedeutet die Aufschrift „PC“ und die dazugehörige Nummer?
„PC“ steht für Produktcode, das ist die PZN. Sie kann in Form der PPN, d.h. „11 & PZN & 2 Prüfziffern“ oder der NTIN, d.h. „04150“ & PZN & Prüfziffer“ auf die Packung gedruckt oder (z.B. bei parallelimportierten Packungen) geklebt sein.
Gibt es optische Hinweise darauf, dass es sich um einen anderen 2-D-Code als den Securpharm-Code handelt?
Die gibt es. QR-Codes haben drei kleine Quadrate in den Ecken des Codes. Bei Indischen Codes steht im Klartext „GTIN“ statt „PC“ oder PC beginnt nicht mit „11“ oder „04150“.
Ich bekomme eine Fehlermeldung. Bedeutet das, das Arzneimittel ist gefälscht?
Nicht jeder Alarm lässt sofort auf einen Fälschungsverdacht schließen – auch technische Fehler auf Seiten der Hersteller oder eigene Handhabungsfehler wie etwa ein versehentliches doppeltes Ausbuchen sind denkbar. Gerade in der Anfangsphase ist noch mit Fehlalarmen zu rechnen. Lässt sich die Packung eindeutig als Bestandsware (Meldung: „eventuell Bestandsware ...“) identifizieren und weist sie auch sonst keine Auffälligkeiten auf, die für eine Fälschung sprechen, kann die Packung abgegeben werden.
Wie gehe ich bei einer „anderslautenden“ Fehlermeldung vor?
Ist der Fehler nicht unmittelbar zu klären, zum Beispiel weil ein Handhabungsfehler vorliegt, bleibt mindestens der Verdacht einer Fälschung. Dann ist die Apotheke verpflichtet, die Packung in Quarantäne zu nehmen. Gesetzlich verankert ist das im neuen § 21 Absatz 5 Apothekenbetriebsordnung (ApBetrO), der am 9. Februar in Kraft treten wird.
Das Arzneimittel ist in Quarantäne, wie geht es für die Apotheke weiter?
Ist das betroffene Arzneimittel zur Seite geschafft, muss der Apotheker erst einmal nichts tun. Der betroffene pharmazeutische Unternehmer bekommt über das System eine Meldung. Er wird aufgefordert, den Fall zu untersuchen – und dafür hat er sieben Tage Zeit. Innerhalb dieser Frist muss der Unternehmer also klären, ob wirklich ein Fälschungsfall vorliegt oder ob er diesen Verdacht ausräumen und den Fehler beseitigen kann. Kann er den Fehler beseitigen, gibt es in der Apotheke wieder „grünes Licht“ für die Abgabe der Packung. Gibt der Hersteller jedoch innerhalb dieser 7-Tage-Frist keine Entwarnung, meldet Securpharm den Fälschungsverdachtsfall an die zuständige Behörde (BfArM). Dann muss auch der Apotheker aktiv werden und seine Aufsichtsbehörde sowie die AMK unterrichten.
Wie erfährt die Apotheke, ob der pharmazeutische Unternehmer den Fälschungsverdachtsfall innerhalb der genannten Frist ausräumen konnte?
Da muss sie sich selbst drum kümmern. Die NGDA wird den Apotheken eine Informationsmöglichkeit im Portal unter https://securpharm-gui.ngda.de zur Verfügung stellen. Wann die Seite live geht, ist derzeit nicht klar.
Wen muss die Apotheke im Falle eines Fälschungsverdachts informieren?
Bei jedem Fälschungsverdacht (ungeklärte Fehlermeldung, tatsächlicher Verdacht wegen eines beschädigten Packungssiegels) muss die Apotheke die AMK, die zuständige Aufsichtsbehörde sowie den Großhandel (Lieferanten) informieren.
Warum den Großhandel?
Die Apotheke muss den beliefernden Großhändler über einen festgestellten Fälschungsverdacht informieren, um nicht den Verlust ihrer Gewährleistungsrechte zu riskieren. In welchem Umfang (Stichproben) und in welchem Zeitraum das passieren muss, kann aber laut ABDA derzeit nicht allgemein gültig beantwortet werden. Die Empfehlung lautet daher: Packungen bereits beim Wareneingang überprüfen. Da ist außerdem die sichere Zuordnung einer Lieferung zu einem konkreten Großhändler noch möglich.
Wie sich die Reklamation auswirkt, zum Beispiel ob die Apotheke die Zahlung verweigern kann, hängt von den jeweiligen Vertragsbedingungen ab.
Nimmt der Großhandel für die FAM-Prüfung geöffnete Packungen zurück?
Muss ich ein Arzneimittel nach negativer Verifizierung zwingend in der Apotheke aufbewahren oder kann ich es auch an den Lieferanten zurückgeben?
Diese Frage ist nicht abschließend geklärt. Laut Bundesgesundheitsministerium (BMG) soll das entsprechende Arzneimittel zunächst nicht an den Großhändler zurückgesendet werden. Das BMG begründet dies damit, dass es sich um ein Arzneimittel handelt, bei dem zumindest ein Anfangsverdacht besteht, dass es gefälscht sein könnte. Das sollte mindestens solange nicht in das Vertriebsnetz gelangen dürfen, bis die Entscheidung über das weitere Vorgehen getroffen wurde.
Außerdem geht das Ministerium davon aus, dass Securpharm das Ergebnis an die verifizierende Stelle zurückmeldet, sodass bei einer Rücksendung der Ware von der Apotheke an den Großhandel Informations- und Warenströme auseinanderlaufen würden.
Die ABDA meint dagegen, dass ein solches Arzneimittel durchaus auch an den Lieferanten zurückgegeben werden kann, es also zwei Handlungsoptionen gibt. So schreibt sie es auch in ihren FAQ und bestätigt es aktuell in einer Information zum „Umgang mit der Pflicht zur Separierung ab dem 9. Februar 2019“. Die technischen Möglichkeiten, auch bei einer Rücksendung die entsprechenden Daten abzurufen, um den Meldepflichten nachzukommen, soll die NGDA zur Verfügung stellen, heißt es. Die Entscheidung, wie er im Einzelfall vorgeht, sollte am Ende der Apothekenleiter in eigener Verantwortung treffen, meint die ABDA.
Derzeit lässt sich sagen: Mit der BMG-Empfehlung ist man jedenfalls auf der sicheren Seite.
Muss ich die getroffenen Maßnahmen nach einem Alarm dokumentieren?
Der neue § 21 ApBetrO schreibt vor, dass die getroffenen Maßnahmen in der Apotheke zu dokumentieren sind.
Was ist zu tun, wenn es neben der negativen Verifikation andere Indizien gibt, die auf einen Fälschungsverdachtsfall hindeuten?
Dann muss dies unmittelbar der Aufsichtsbehörde und der AMK gemeldet werden. Dann ist die 7-Tage-Regel hinfällig.
Mehr zum Thema

Wichtiges vor dem Start
Fertigarzneimittelprüfung und Securpharm – so geht’s
Ist der Erstöffnungsschutz einheitlich?
Nein, es kann verschiedene Varianten geben, zum Beispiel Klebesiegel, verklebte Packung mit perforierter Lasche oder Drehverschlüsse mit Sicherungsring.
Dürfen Apotheker die Packung zu Prüfzwecken öffnen?
Apotheker dürfen, wie bisher, die mit dem Erstöffnungsschutz versehene Packung zu Prüfzwecken im Rahmen der FAM-Prüfung gemäß ApoBetrO öffnen, wenn Sie die Packung nach positiver Prüfung entsprechend kennzeichnen. Diese Kennzeichnung ist bei Bedarf dem Patienten vor der Abgabe zu erklären. Ob es eine Änderung der Apothekenbetriebsordnung geben wird, ist derzeit nicht klar.
Chargenüberprüfungen werden wegen des finanziellen Risikos für die Apotheken nicht mehr empfohlen. Die entsprechenden Arzneimittel sollen durch die pharmazeutische Industrie stattdessen zurückgerufen werden, heißt es in den FAQ der ABDA.
Was passiert, wenn der Erstöffnungsschutz nicht intakt ist?
Wurde er in der Apotheke geöffnet, zum Beispiel für die Fertigarzneimittelprüfung, kann die Packung abgegeben werden. Die Packung muss dann entsprechend gekennzeichnet und der Bruch dokumentiert werden. Bei einem Bruch des Originalitätsverschlusses außerhalb des Kontrollbereichs der Apotheke, verliert die Packung ihre Abgabefähigkeit und muss als Fälschungsverdacht an die AMK und die zuständige Aufsichtsbehörde gemeldet werden.
Es gibt keinen Erstöffnungsschutz. Was tun?
Wenn es sich um Bestandsware oder OTC (außer Omeprazol) handelt, kann die Packung abgegeben werden. Ist das nicht Fall, muss sie als Fälschungsverdacht an die AMK und die zuständige Aufsichtsbehörde gemeldet werden.
Kann man für die FAM-Prüfung geöffnete Packungen an den Großhandel zurückgeben?
Die Großhändler erklären auf Nachfrage, dass sie diese Packungen nicht zurücknehmen, weil die Öffnung außerhalb ihres Kontrollbereichs stattgefunden hat. Es empfiehlt sich also in der Praxis, vor allem Packungen zu prüfen, die sicher verkauft werden, oder Arzneimittel ohne Erstöffnungsschutz.
Entsorgen, stellen und ausfüllen
Ich hab ein falsches Arzneimittel beim Großhandel bestellt. Was muss ich tun?
Ein falsch bestelltes Arzneimittel kann zwar überprüft werden, darf aber nicht aus dem System ausgebucht werden. Der Status des Medikaments im System muss weiterhin „abgabebereit“ bleiben. Der Großhändler wird den Status bei Rücknahme der Packung überprüfen.
Kann man noch „ausfüllen“?
Eine Abgabe von Teilmengen ist nur auf ausdrückliche ärztliche Verordnung erlaubt. Deswegen wird es eine offizielle Empfehlung zum Auseinzeln nicht geben.
Zum Thema „Abgabe von Teilmengen“ heißt es: „Sofern eine Abgabe von Teilmengen verordnet ist, muss die Packung beim ersten Öffnen ausgebucht werden. Da ein Teil ihres Inhalts abgegeben wurde, kann sie nicht wieder eingebucht werden. Der Rest der Packung bleibt aber grundsätzlich verkehrsfähig und kann, bei einer entsprechenden Teilmengenverordnung, in dieser Apotheke abgegeben werden.
Wie entsorge ich verfallene oder beschädigte Packungen?
Vor der Entsorgung einer verfallenen oder beschädigten Packung muss der Code ausgebucht werden.
Wie geht man beim Stellen von Medikamenten vor?
Beim patientenindividuellen Stellen von Medikamenten wird die Packung vor dem ersten Öffnen ausgebucht. Sonst ändert sich nichts.
Und beim Verblistern?
Auch beim Verblistern von Medikamenten wird vor dem ersten Öffnen der Packung ausgebucht. Sonst ändert sich nichts.
Wie geht man bei einer technischen Störung (Internetausfall etc.) vor?
Im Falle einer technischen Störung zum Zeitpunkt der Abgabe darf das Arzneimittel ausnahmsweise ohne Verifizierung abgegeben werden. Die Echtheit sollte ja schon zuvor beim Wareneingang überprüft worden sein. Verifizierung und Ausbuchung müssen nachgeholt werden, sobald die Störungen behoben sind. Dafür muss die Seriennummer und der Produktcode bei der Abgabe notiert (oder der Data-Matrix-Code abfotografiert) und die Packung nachträglich manuell ausgebucht werden. Softwarehäuser bieten für den Fall eines alleinigen Ausfalls des Internets auch vorübergehende Speicherfunktionen mit nachträglicher automatischer Ausbuchung an.





























1 Kommentar
Bestandsware
von Stefan Schwenzer am 07.02.2019 um 21:46 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.