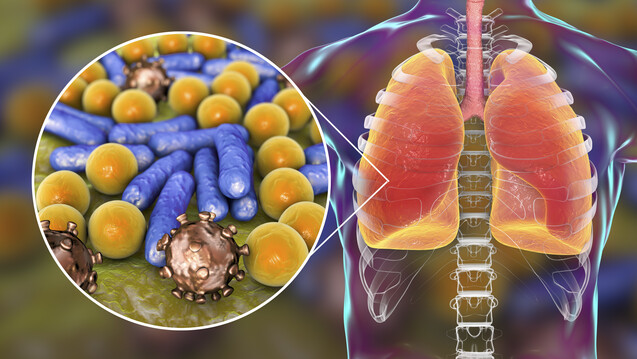
Was bedeutet MRGN 3 und MRGN 4?
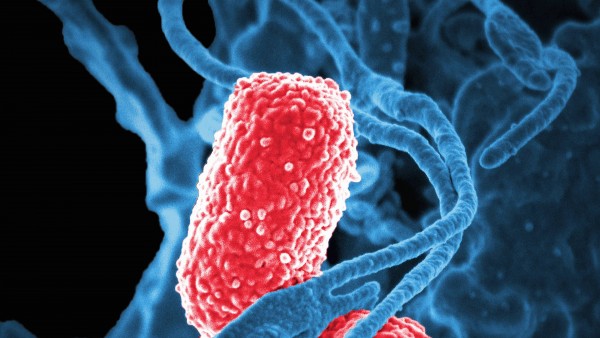
Die Definition von MRGN ist noch nicht sehr alt. Tatsächlich definierte erst 2012 das Robert-Koch-Institut (RKI) damit multiresistente gramnegative Stäbchen-Bakterien. Unter anderem wurden dabei auch vier Antibiotikaklassen definiert, die bei Infektionen mit gramnegativen Erregern Einsatz finden: Acylureidopenicilline (Leitsubstanz: Piperacillin), Cefalosporine der 3./4. Generation (Leitsubstanz: Cefotaxim/Ceftazidim), Carbapeneme (Leitsubstanz: Meropenem), Fluorchinolone (Leitsubstanz: Ciprofloxacin). Der Abkürzung MRGN werden Ziffern von 1 bis 4 nachgeordnet, wobei diese die Anzahl an Resistenzen gegen die definierten antibiotischen Klassen beschreiben. Liegt eine Resistenz gegen eines oder zwei der Antibiotika-Klassen vor, sind diese Infektionen in der Regel unkritisch zu behandeln. Daher findet man die Abkürzungen MRGN 1 oder MRGN 2 eher selten. Kritischer sieht es aus bei MRGN 3 und MRGN 4, wenn Enterobakterien (unter anderem Klebsiella pneumoniae), Pseudomonas aeruginosa oder Acinetobacter baumanii gegen drei oder vier der Antibiotika nicht mehr sensibel sind. Die Resistenzen beruhen meist auf der Bildung von Betalactamasen, bei MRGN 4 sind diese häufig Carbapenemasen.
Bei Klebsiella pneumoniae oder Acinetobacter baumanii vom Typ MRGN 3 wirken nur noch Carbapeneme (Imipenem, Meropenem). Bei Pseudomonas aeruginosa MRGN 3 ist die Empfindlichkeit auf Ceftazidim und Cefepim reduziert.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.