
- DAZ.online
- News
- Spektrum
- AOK-Rabattarzneimittel ...
Arzneimittel-Skandal
AOK-Rabattarzneimittel wegen Lunapharm-Affäre unter Quarantäne
Berlin - 14.09.2018, 14:20 Uhr

Einige AOKen haben Rabattverträge mit NMG Pharma. Das Unternehmen unterhielt Geschäftsbeziehungen zu Lunapharm und hat nun mehrere biophamazeutische Importe zurückgerufen. ( r / Foto: Sket)
AOK Sachsen-Anhalt rechnet nicht mit weiteren Chargen-Rückrufen
Gegenüber DAZ.online erklärte die Sprecherin weiter, dass das Landesverwaltungsamt die Apotheken identifiziert habe, in denen die zurückgerufenen Chargen ausgegeben wurden. Von den benannten Chargen sei angeblich noch eine Packung in einer Apotheke verfügbar gewesen. Diese sei nun in Quarantäne genommen worden. Probleme für die eigenen Rabattverträge sieht die AOK Sachsen-Anhalt offenbar nicht: „Da sich NMG nach Bekanntwerden der Vorwürfe von Lunapharm getrennt hat, gehen wir nach aktuellem Stand davon aus, dass für die Zukunft keine weiteren Chargen betroffen sind“, so die Sprecherin.
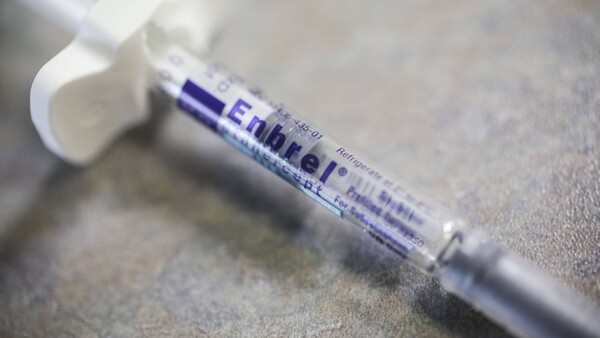
Ob und welche Gefahr von den NMG-Arzneimitteln ausgeht, für die die AOK Sachsen-Anhalt einen Rabattvertrag hatte, ist unklar. Fest steht aber dies: Humira® (Adalimumab) war einer der Wirkstoffe, der zuletzt in Verdacht war, von Lunapharm aus Italien importiert worden zu sein. Das Paul-Ehrlich-Institut bestätigte, dass man wegen einer ganzen „Liste“ von Arzneimitteln derzeit in Kontakt mit den italienischen Behörden stehe. Konkret geht es um die Frage, ob die von Lunapharm importierte Ware aus Italien gestohlene Klinikware ist. Denn schon seit Jahren werden Hochpreiser aus italienischen Klinikapotheken geraubt und dann über verschiedene Wege ins restliche Europa verkauft.
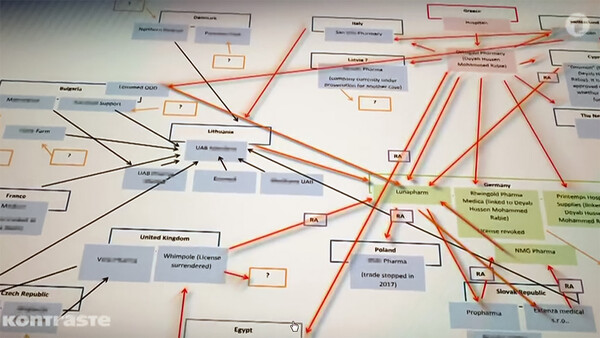
Dass Lunapharm und NMG-Pharma recht enge Geschäftsbeziehungen unterhielten, dürfte auch klar sein. Erst kürzlich erklärte die Bezirksregierung Köln gegenüber DAZ.online, dass Lunapharm auch an der Lieferkette der Ware, die NMG in dieser Woche zurückrief, beteiligt gewesen sei. „Ob es sich um Arzneimittel handelt, die von außerhalb der legalen Lieferkette stammen, ist derzeit nicht abschließend geklärt. Hier bleibt es, weitere Erkenntnisse in der Sache abzuwarten, die außerhalb der Zuständigkeit der Bezirksregierung Köln erhoben werden müssen“, erklärte die Sprecherin der Bezirksregierung Köln.


























1 Kommentar
Ich glaube dem PEI
von Dr. Andreas van de Valk am 15.09.2018 um 21:54 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.