
- DAZ.online
- News
- Pharmazie
- Antibiotika-Resistenzen: ...
90 Jahre Penicillin
Antibiotika-Resistenzen: Bereits Fleming warnte
Berlin - 15.09.2018, 08:00 Uhr

Penicillin-Entdecker Alexander Fleming warnte während seiner Nobelpreisrede 1945 vor der Möglichkeit von Resistenzbildungen durch Penicillin-Einsatz. ( r / Foto: imago / United Archives International)
Die Entdeckung des Lebensretters Penicillin feiert in diesem Jahr sein 90-jähriges Jubiläum. Es ist eine der wichtigsten medizinischen Errungenschaften des 20. Jahrhunderts. Der Einsatz von Antibiotika rettete seither millionenfach Leben. Doch die WHO schlägt Alarm: Antibiotika verlieren durch Multiresistenzen zunehmend ihre Wirkung. Bereits Alexander Fleming warnte vor der Gefahr von Resistenzbildungen. Was sind die Ursachen? Und mit welchen Strategien kann dieser Entwicklung begegnet werden?
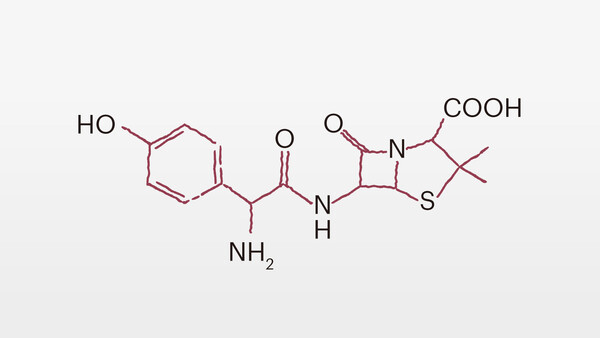
Vor 90 Jahren, im September 1928, verhalf der Zufall dem schottischen Mediziner und Bakteriologen Alexander Fleming (1881-1955) zu seiner größten Entdeckung: das Penicillin. Anfang des 20. Jahrhunderts waren die Ursachen von Infektionen zwar meist bekannt, es fehlte aber immer noch an wirksamen Behandlungen. Das sollte sich mit dem zur Gruppe der Beta-Lactam-Antibiotika gehörenden Penicillin ändern. Doch auch die Problematik von Resistenzbildungen begleitete von Anfang an den Einsatz von Antibiotika.
Zufall half Penicillin-Entdeckung auf die Sprünge
Alexander Fleming wurde am 6. August 1881 in einem kleinen schottischen Dorf in der Grafschaft Ayrshire geboren. Er studierte in London Medizin. Nach Beendigung seines Studiums arbeitete in der Bakteriologie des Saint Mary’s Hospitals. Erfahrungen als Lazarettarzt während des Ersten Weltkrieges bekräftigten seine Suche nach einer wirksamen Bekämpfung von pathogenen Keimen, die er nach seiner Rückkehr am Saint Mary’s Hospital fortsetzte.
Mikrobiologie
Antibiotikaresistenz
Fleming entdeckte durch Zufall im September 1928 auf einigen der Petrischalen einer seiner Staphylokokken-Versuchsreihen eine ungewollte Schimmelpilzbildung. Doch er beseitigte die „verunglückten“ Versuchsansätze nicht einfach, er beobachtete genau. Dort wo der Schimmelpilz der Art Penicillium chrysogenum, damals noch Penicillium notatum genannt, mit den Staphylokokken in Berührung gekommen war, gab es nun keine Bakterien mehr. Stattdessen beobachtete er regelmäßige runde Höfe in den mit dem Pilz befallenen Petrischalen. Fleming folgerte, dass eine Substanz aus dem Schimmelpilz die Staphylokokken bekämpft haben musste. Er nannte diese Substanz Penicillin.
Ernest Duchesne – Entdeckung wurde nicht anerkannt
Dieser natürliche Antagonismus zwischen Bakterien und Schimmelpilzen war allerdings keine neue Entdeckung. Bereits in der zweiten Hälfte des 19. Jahrhunderts hatte der französische Militärarzt Ernest Duchesne die antibakterielle Wirkung bestimmter Schimmelpilzarten beobachtet. Duchesne experimentierte mit Penicillium glaucum und dokumentierte seine antibakteriellen Eigenschaften. Seine Doktorarbeit zum Thema aus dem Jahre 1897 wurde allerdings abgelehnt und seine Forschungen konnten nicht fortgesetzt werden. Penicillium glaucum wird heutzutage als Edelschimmel bei der Käseherstellung verwendet.
Medizin-Nobelpreis für Fleming, Florey und Chain
Mehr Glück hatte Alexander Fleming, obwohl seine erste Publikation zur antibiotischen Wirksamkeit des Penicillins im „British Journal of Experimental Pathology“ im Jahre 1929 nur auf wenig Resonanz stieß. Fleming ließ sich davon nicht beirren und wies die bakterizide Wirkung und die Unbedenklichkeit des Penicillins nach. Es gelang ihm allerdings aufgrund nicht ausreichender eigener biochemischer Kenntnisse und dem Fehlen eines geeigneten Teams nicht, den Stoff weitergehend zu untersuchen. Einige Forscher interessierten sich dennoch für die Entdeckung Flemings. Sie baten um Proben der Penicillium-Sporen. Fleming stand diesen Bitten aufgeschlossen gegenüber und stellte den Pilz seinen Kollegen weltweit zur Verfügung.
Einer Forschergruppe um die Chemiker Howard Florey und Ernst Chain von der Universität Oxford gelang es schließlich ab 1940, Benzylpenicillin (Penicillin G) zu isolieren und in größeren Mengen herzustellen. Da Großbritannien durch die Folgen des Zweiten Weltkrieges nicht in der Lage war, Penicillin industriell zu produzieren, übernahmen die USA die Herstellung im großen Maßstab. Der Zweite Weltkrieg erwies sich als Katalysator der Penicillinentwicklung. Das amerikanische Militär war ganz „verrückt“ nach dem Antibiotikum und erhoffte sich positive Auswirkungen für die alliierten Truppen. Ein regelrechter Hype um das Wundermittel entstand. In Deutschland stand Penicillin damals noch nicht zur Verfügung. 1945 wurden schließlich Fleming, Florey und Chain mit dem Medizin-Nobelpreis ausgezeichnet.
Sulfonamide behinderten zunächst Penicillin-Erfolg
Während Fleming mit der Erforschung des therapeutischen Einsatzes von Penicillin beschäftigt war, schritt gleichzeitig die Entwicklung chemotherapeutischer Wirkstoffe fort. Insbesondere die Entwicklung der Sulfonamide bedrängte zunächst den Penicillin-Erfolg. 1932 wurde die sehr erfolgreich gegen verschiedene schwere bakterielle Infektionen wie Hirnhautentzündung und Lungenentzündung eingesetzte Wirkstoffklasse der Sulfonamide entdeckt. Grundlage waren Forschungen von Gerhard Domagk (1895–1964) und seinem Team über die antibakterielle Wirkung verschiedener Azo-Farbstoffe. Gefunden wurde der Farbstoff Sulfamidochrysoidin (Prontosil®), der gegen Streptokokken wirkte und zugleich ausreichend verträglich für den Menschen war. Die Bedeutung der Sulfonamide wurde erst durch die Entdeckung des Penicillins allmählich zurückgedrängt.
Resistenzbildungen – schon Fleming warnte
Die Erkenntnisse zur Bekämpfung bakterieller Infektionskrankheiten stellten bahnbrechende Fortschritte in der Medizin dar. Die Sterblichkeit sank, Infektionskrankheiten konnten bekämpft und Operationen sicherer durchgeführt werden. Der medizinische Fortschritt wurde bei aller damaligen Euphorie jedoch zunehmend durch Resistenzbildungen gefährdet. Schon Alexander Fleming warnte, dass eine unsachgemäße Anwendung des Penicillins Bakterien unempfindlich gegen das Beta-Laktam-Antibiotikum machen könnte. „Es besteht die Gefahr, dass die Mikroben lernen, resistent gegen Penicillin zu werden. Und wenn die Mikrobe einmal resistent ist, bleibt sie auch für lange Zeit resistent.“
Für Fleming unterlag der Einsatz des Penicillins bestimmten Regeln: Antibiotika dürften nur bei gegen den Wirkstoff empfindlichen Bakterien eingesetzt werden. Die Applikation müsse den Kontakt zum Erreger gewährleisten. Zudem müsse der Wirkstoff ausreichend hoch dosiert und lange genug angewandt werden. Lange Zeit waren die Erkenntnisse Flemings Standard in der antibiotischen Therapie – oder hätten es zumindest sein sollen. Aber gerade das „ausreichend hoch und lange“ wird laut aktueller wissenschaftlicher Empfehlungen in ein „so kurz wie möglich, so lang wie nötig“ modifiziert. Heutzutage sollten bakterielle Infektionskrankheiten leitliniengerecht und sachgemäß bekämpft werden – und gleichzeitig die aktuelle Resistenzsituation und der Zustand des Patienten als Grundlagen für Verordnungsentscheidungen beachtet werden. Die Wirklichkeit sieht allerdings nicht immer so aus.
Resistenzbildung – evolutionäre Abwehrstrategie durch Menschen verstärkt
Ein Keim gilt als resistent, wenn die minimale Hemmkonzentration (MHK), also die minimale Konzentration eines antimikrobiellen Wirkstoffes, die in vitro das Wachstum eines Erregers hemmt, höher liegt als die höchste in vivo nicht toxische Serum- bzw. Gewebekonzentration. Das bedeutet: Mehr geht nicht – und weniger hilft nicht mehr. Es kann zudem zu Kreuzresistenzen kommen. Diese werden durch chemisch verwandte Antibiotika oder solche mit gleichem Wirkmechanismus ausgelöst. Ferner werden im Rahmen von Antibiotikabehandlungen auch Einflüsse auf die natürliche Bakterienflora beobachtet und eine Selektion resistenter Keime in der Normalflora (Resistenzselektion).
Resistenzbildungen bei Bakterien beruhen letztlich auf evolutionäre Abwehrstrategien, die sich gegen für sie schädliche Substanzen richten. Die Resistenzmechanismen laufen mit unterschiedlichen Auswirkungen sowohl auf Genebene als auch auf Proteinebene ab. Dabei kann es sowohl zu chromosomalen Resistenzen kommen, die weitervererbt werden, aber nicht auf andere Bakterien übertragen werden, als auch zu übertragbaren extrachromosomalen Resistenzen. Auf Proteinebene können unterschiedliche Reaktionen in der Bakterienzelle ausgelöst werden wie zum Beispiel Veränderungen der Zellpermeabilität, die es den Antibiotika erschweren, zum Wirkort zu gelangen.
Der Mensch kann durch – vor allem einen unsachgemäßen – Einsatz von Antibiotika die Resistenzbildungsraten verstärken. Zu den Problemfeldern gehört der großflächige Einsatz von Antibiotika in der industriellen Tierhaltung und in der Landwirtschaft ebenso wie unsachgemäße Verordnung von Antibiotika beim Menschen. Ein rationales Antibiotikaverordnungsverhalten und der zurückhaltende Einsatz von Reserveantibiotika sind wichtige Voraussetzungen zur Eindämmung der Resistenzbildung. Leider zeigt die Realität teilweise ein anderes Bild mit entsprechenden Folgen.
Suche nach neuen Wirkstoffen – und neuen Therapieansätzen
Verschiedene Strategien werden zurzeit weltweit in den Forschungslaboren verfolgt: So setzen Forscher zum Beispiel auf sogenannte „vergessene Antibiotika“ und versuchen diese bisher wenig eingesetzten Wirkstoffe mit verbesserten pharmazeutischen Formulierungen für den Markt aufzubereiten. Außerdem hofft die Wissenschaft auf neue Wirkstoffe und innovative Therapieansätze. Unter anderem wird am Kieler Evolution Center (KEC) der Christian-Albrechts-Universität an neuen Behandlungsansätzen geforscht, die sich an Erkenntnissen der Evolution orientieren. Ergebnis ist zum Beispiel das „Konzept der kollateralen Sensitivität“, bei dem eine Resistenzbildung gegenüber einem bestimmten Antibiotikum zu einer erhöhten Empfindlichkeit gegenüber einem anderen Wirkstoff führt. Das funktioniert vor allem bei einer Kombination von Antibiotika mit unterschiedlichen Wirkmechanismen.
Eine der Möglichkeiten Bakterien zu bekämpfen, ist eigentlich schon ein alter Bekannter – und wird in Osteuropa seit langem angewandt: der Einsatz von Bakteriophagen. In Deutschland beschäftigt sich das Forschungsprojekt „Phage4Cure“, in dem vier große deutsche Forschungsinstitutionen zusammenarbeiten, mit diesem Therapieansatz. Vorteil: Bakteriophagen können sehr selektiv an den Bakterienoberflächen andocken. Danach schleusen sie ihr Erbgut in die Bakterienzelle ein. Die Vermehrung der Phagen lässt schließlich das Bakterium platzen. Nach getaner Arbeit werden die Bakteriophagen, die vom menschlichen Immunsystem nicht bekämpft werden, da sie überall in der natürlichen Umwelt vorkommen, einfach vom Körper abgebaut. Es kommt zudem zu keiner Schädigung der natürlichen Bakterienflora. Durch das Projekt „Phage4Cure“ sollen durch systematische klinische Studien zur Wirksamkeit und Verträglichkeit, die Voraussetzungen für eine Zulassung als Arzneimittel in der EU geschaffen werden.
WHO: Antibiotika-Resistenzen weltweites Problem
Die WHO warnt schon seit Jahren, dass bedingt durch eine weltweite Zunahme von antibiotikaresistenten Keimen vermehrt Menschen durch einfache Infektionen sterben könnten. Eine von der WHO im Jahre 2014 vorgenommene Einschätzung zur globalen Antibiotikaresistenz-Situation kam zu dem Ergebnis, das die Datenlage zu Resistenzbildungen nicht ausreichend sei und nicht alle Länder eine Überwachung der Antibiotikaverordnungen durchführten. Die Lage sei global gesehen sehr heterogen. Die wenigen Daten von Ländern außerhalb Europas und Nordamerikas ließen allerdings eine hohe Resistenzbildungsrate vermuten.
Seit 2015 gibt es den Globalen Aktionsplan zur Bekämpfung von Antibiotika-Resistenzen der WHO. Grundlage dieses Planes ist der sogenannte „One Health“-Ansatz, der eine gemeinsame Herangehensweise von Human- und Veterinärmedizin sowie der Landwirtschaft bei der Bekämpfung von Resistenzen fordert. Zudem sollen die Mitgliedsstaaten nationale Pläne verabschieden und umsetzen. In Deutschland geschieht das durch die Deutsche Antibiotika-Resistenzstrategie (DART 2020).




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.