
- DAZ.online
- News
- Apotheke
- EMA untersucht ...
Europaweite Valsartan-Rückrufe
EMA untersucht Verunreinigung in valsartanhaltigen Arzneimitteln
Stuttgart - 06.07.2018, 13:15 Uhr

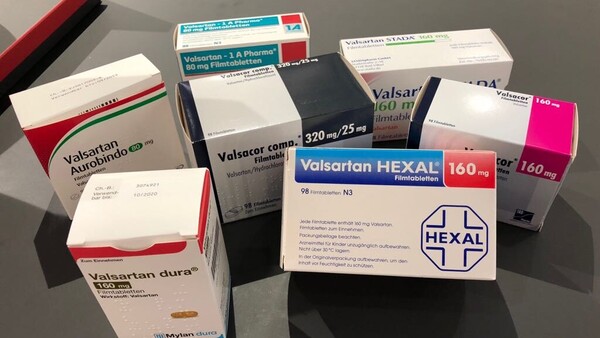
Mit der NDMA-Verunreinigung im Valsartan hat laut EMA keiner gerechnet – sie war „unexpected“. Man gehe davon aus, dass sie von einer Veränderung im Produktionsprozess des Valsartans herrührt. ( j / Foto: PA Images / imago)
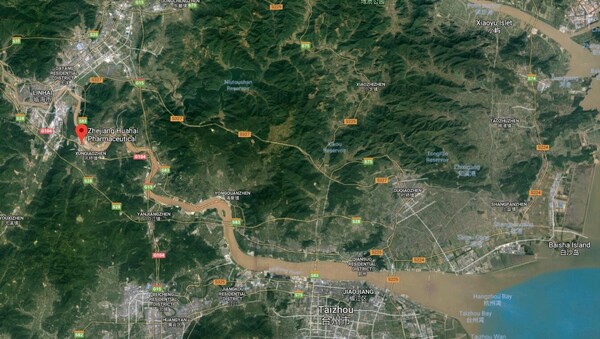
Noch am gestrigen Donnerstag hat sich auch die Europäische Arzneimittelagentur in einer Pressemitteilung zu den EU-übergreifenden Valsartan-Rückrufen geäußert. Die EMA prüft gerade die Hintergründe zum verunreinigten Valsartan des chinesischen Wirkstoffherstellers Zhejiang Huahai Pharmaceuticals, der auch viele deutsche Pharmahersteller mit dem Wirkstoff beliefert. Bis jetzt haben in Deutschland sieben Unternehmen einen Rückruf angeordnet.
Gestern, am 5. Juli
2018, hat die Europäische Kommission unter dem „Article 31 of Directive
2001/83/EC“ Untersuchungen der EMA (Europäische Arzneimittelagentur) eingeleitet: Es
geht um die verunreinigten valsartanhaltigen Präparate, die den Wirkstoff des chinesischen Herstellers
Zhejiang Huahai Pharmaceuticals enthalten. Wichtig dabei zu wissen: „Der in der
Packungsbeilage angegebene Hersteller ist der Hersteller, der die Verantwortung
für die Gesamtherstellung hat und das Arzneimittel für die Verwendung freigibt
(„Endfreigebender Hersteller“)“, das schreibt das BfArM auf seiner
extra zum Valsartan-Rückruf eingerichteten Internetseite, die unter www.bfarm.de/valsartan zu erreichen ist. Der Wirkstoffhersteller stellt also nur den im Arzneimittel verwendeten Wirkstoff her, und dieser ist im aktuellen Fall Ursache der Verunreinigung. In weiteren Herstellungsschritten wird der Wirkstoff in der Regel von anderen Herstellern zum Fertigarzneimittel weiterverarbeitet (Kapseln, Tabletten). Sieben „endfreigebende Hersteller" – Dexcel, Heumann, Hormosan, Hexal, Zentiva, Aliud und Basics –
haben bereits den vorsorglichen Rückruf aller oder bestimmter Chargen
valsartanhaltiger Arzneimittel erklärt. Einige Hersteller gaben auch schon
Entwarnung: Marktführer TAD, sowie Mylan und Novartis.
Hier finden Sie alle bisherigen Rückrufe

Valsartan-Rückrufe
Auch 1 A Pharma und Stada rufen zurück

Europaweite Rückrufe
BfArM informiert zu Valsartan
Valsartan-Rückrufe
Hexal ruft zurück, TAD Pharma nicht betroffen
Verunreinigungen
Valsartan-Rückrufe starten – einige Rabattverträge betroffen
Wirkstoffhersteller meldete Verunreinigung selbst
Ausgelöst hat die nun eingeleiteten Untersuchungen der EMA (Europäische Arzneimittelagentur) – der Pressemitteilung zufolge – der chinesische Wirkstoffhersteller selbst, nachdem er die Verunreinigung N-Nitrosodimethylamin (NDMA) im Wirkstoff Valsartan detektiert hatte. Mit der NDMA-Verunreinigung habe keiner gerechnet – sie war laut EMA „unexpected“. Man gehe davon aus, dass sie von einer Veränderung im Produktionsprozess des Valsartans herrührt.
Konkret nimmt sich der Ausschuss „Committee for Medicinal Products for Human Use“ (CHMP) der Untersuchungen an. Die Erkenntnisse und die Schlussfolgerungen daraus werden dann an die Europäische Kommission weitergeleitet, die am Ende ein rechtlich bindendes Statement für alle EU-Staaten herausgeben wird. Die EMA informiert auch die Pharmafirmen zum Vorgehen auf ihren Internetseiten.
Was die EMA bezüglich der Valsartan-Verunreinigungen untersucht
Die EMA kündigt weiterhin an, dass man den Grad der NDMA-Verunreinigung untersuchen werde. In der Folge wird dann analysiert, welche Auswirkungen das auf betroffene Patienten haben könnte, die verunreinigte Arzneimittel eingenommen haben. Im nächsten Schritt müssten dann Maßnahmen ergriffen werden, die die NDMA-Verunreinigung im Valsartan des chinesischen Herstellers in Zukunft reduzieren oder eliminieren. Als Vorsichtsmaßnahme werde die EMA auch untersuchen, ob andere Valsartan-Medikamente („valsartan medicines“) betroffen sind. Auch die EMA weist darauf hin, dass NDMA beim Menschen „wahrscheinlich karzinogen“ wirkt – basierend auf Labor-Daten.
Die EMA informiert die Patienten
In ihrem Statement richtet sich die EMA auch direkt an die Patienten, darin heißt es unter anderem:
- Nur manche Valsartan-Präparate in der EU seien betroffen. Diese werden zurückgerufen.
- Niemand solle seine valsartanhaltigen Präparate absetzen, es sei denn ein Arzt oder Apotheker habe dazu geraten.
- Beim nächsten Arztbesuch kann der Arzt ein Rezept über ein nicht betroffenes (Valsartan-)Präparat ausstellen.
- Wer Fragen zu seinem Valsartan-Präparat hat, soll sich an seine Apotheke wenden, die Auskunft über die aktuellen Rückrufe geben kann.
- Wer an einer Klinischen Studie teilnimmt, in der Valsartan Teil der Behandlung ist, soll sich an seinen behandelnden Arzt wenden.
- Welches Risiko die NDMA-Verunreinigung für
Patienten darstellt, wird die EMA bewerten. Entsprechende Informationen werden –
sobald verfügbar – bekannt gegeben.
Die Entscheidung über den europaweiten Rückruf erfolgte am vergangenen Dienstag, der Rückruf selbst begann am 4. Juli. An diesem Tag hatte sich der Jour Fixe zu Liefer- und Versorgungsengpässen beim BfArM intensiv mit dem Thema und den möglichen Auswirkungen befasst. Mitglieder des Jour Fixe sind unter anderem auch die Verbände der Pharmazeutischen Industrie und die Arzneimittelkommissionen der Ärzte- und Apothekerschaft.




























4 Kommentare
Valsartan Verunreinigung
von Schulz am 13.07.2018 um 14:04 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Valsartan Rückruf
von Helga Wolterinck am 08.07.2018 um 13:27 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Hautausschlag/Valsartan
von Schwarz am 12.07.2018 um 7:53 Uhr
Valsartan-Verunreinigung
von Katja Enders am 07.07.2018 um 8:58 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.